Immunregulation & Leberentzündung
Molekulare Immunologie und Gastroenterologie
-
AG Huber: Intestinal Immune Regulation
You can find further information here .
-
AG Hübener: Endogene Alarmsignale in Regulation von Immunantworten
Endogene Alarmsignale in Regulation von Immunantworten
Entzündliche Prozesse sind Bestandteil der komplexen immunologischen Antwort eines Organismus auf sterile oder infektiöse Schädigung vaskularisierter Gewebe. Während die entzündungsfördernden Funktionen von inflammatorischen Zytokinen und Chemokinen in vielen Geweben gut untersucht und belegt sind, bleibt ungeklärt, auf welche Weise geschädigte Zellen diese Signalkaskaden auslösen und wie die resultierenden Entzündungsreaktionen reguliert werden. Es wird angenommen, dass in prinzipiell jedem Organ gestresste oder zerfallende Zellen Bestandteile freisetzen können, die über spezifische, evolutionär konservierte Rezeptorsysteme entzündliche Kaskaden und regenerative Prozesse in Gang setzen. Diese zellulären Bestandteile werden als "damage-associated molecular patterns" (DAMPs) oder "Alarmine" bezeichnet. Im Gegensatz dazu gelten klassischerweise molekulare Bestandteile von Pathogenen (z.B. Lipopolysaccharid, LPS) als Auslöser infektassoziierter Entzündungen und werden dementsprechend als "pathogen-associated molecular patterns" (PAMPs) bezeichnet. Diese ursprünglich fast paradigmatische konzeptuelle Unterscheidung zwischen sterilen und infektiösen Entzündungsmechanismen weicht indes zunehmend einem Verständnis, in dem Parenchymzellen, Entzündungszellen und gegebenenfalls exogene Pathogene in ein komplexes Zusammenspiel dynamischer gegenseitiger Beeinflussung treten.
Wir haben gezeigt, dass das ubiquitär exprimierte körpereigene Alarmin High-mobility group box 1 (HMGB1) im Zusammenspiel mit seinem Hauptrezeptor RAGE essenziell für die Rekrutierung von Entzündungszellen nach steriler nekrotischer Gewebsschädigung ist, und dass diese Entzündungszellen aktiv zur Gewebsschädigung beitragen. Der evolutionäre Vorteil dieses Mechanismus könnte in einem "Präventivschlag" gegen mikrobielle Besiedelung von Wundflächen liegen, der um den Preis einer zunächst verstärkten Gewebsschädigung erkauft wird. Der Fokus unserer Arbeitsgruppe liegt daher auf der Rolle körpereigener Alarmsignale in der Initiation und Unterhaltung entzündlicher Prozesse im Rahmen von infektiösen Erkrankungen, die in sehr unterschiedlichem Ausmaß mit qualitativ und quantitativ heterogenen Zell- und Organschädigungen einhergehen. Neben der Aufklärung relevanter zellulärer Effektoren dieser endogenen Schiene der Immunaktivierung befassen wir uns mit der Frage, inwiefern körpereigene Botenstoffe als immunologisches Adjuvans in der Ausbildung einer adaptiven Immunantwort benötigt werden.
Mitarbeiter
Elisabeth Zierz, M.Sc.
Irke Wassmann, M.Sc.
Ausgewählte Publikationen
Volmari A*, Foelsch K*, Zierz E1, Yan K, Qi M, Bartels K, Kondratowicz S, Boettcher M, Reimers D, Nishibori M, Liu K, Schwabe RF, Lohse AW, Huber S, Mittruecker HW, Huebener P. Leukocyte-derived High-mobility group box 1 governs hepatic immune responses against Listeria monocytogenes. Hepatology Communications 2021 doi: https://doi.org/10.1101/797902
Hoste E, Maueröder C, van Hove L, Catrysse L, Vikkula HK, Sze M, Maes B, Karjosukarso D, Martens L, Gonçalves A, Parthoens E, Roelandt R, Declercq W, Fuentes I, Palisson F, Gonzalez S, Salas-Alanis JC, Boon L, Huebener P, Mulder KW, Ravichandran K, Saeys Y, Schwabe RF, van Loo G. Epithelial HMGB1 Delays Skin Wound Healing and Drives Tumor Initiation by Priming Neutrophils for NET Formation. Cell Rep 2019;29:2689-2701.e4.
Hernandez C*, Huebener P*, Pradere JP, Antoine DJ, Friedman RA, Schwabe RF. HMGB1 links chronic liver injury to progenitor responses and hepatocarcinogenesis. J Clin Invest 2018;128:2436-51.
Kleinschmidt D, Giannou AD, McGee HM, Kempski J, Steglich B, Huber FJ, Ernst TM, Shiri AM, Wegscheid C, Tasika E, Hübener P, Huber P, Bedke T, Steffens N, Agalioti T, Fuchs T, Noll J, Lotter H, Tiegs G, Lohse AW, Axelrod J, Galun E, Flavell RA, Gagliani N, Huber S. A Protective Function of IL-22BP in Ischemia Reperfusion and Acetaminophen-Induced Liver Injury. J Immunol 2017;199:4078-90.
Hernandez C*, Hübener P*, Schwabe RF. Damage-associated molecular patterns in cancer a double-edged sword. Oncogene 2016;35:5931-41.
Karimi K, Keßler T, Thiele K, Ramisch K, Erhardt A, Hübener P, Barikbin R, Arck P, Tiegs G. Prenatal acetaminophen induces liver toxicity in dams, reduces fetal liver stem cells, and increases airway inflammation in adult offspring. J Hepatol 2015;62:1085-91.
Hübener P, Gwak GY, Schwabe RF. Comment on: HMGB1-dependent and -independent autophagy. Autophagy 2015;11:1187-88.
Hübener P*, Gwak GY*, Pradere JP, …, Goldberg IJ, Czaja MJ, Schwabe RF. High-mobility group box 1 is dispensable for autophagy, mitochondrial quality control, and organ function in vivo. CellMetab 2014;19:539-47.
Hübener P*, Pradere JP*, Hernandez C*, Gwak GY, Caviglia JM, Mu X, Loike JD, Jenkins RE, Antoine DJ, Schwabe RF. The HMGB1/RAGE axis triggers neutrophil-mediated injury amplification following necrosis. J Clin Invest 2015;125:539-50.
*equally contributing authors
-
AG Schulze zur Wiesch: Role of T cells in infectious diseases
General information and list of ongoing projects
The AG Schulze zur Wiesch aims to understand the immunological control and immunopathology of different chronic viral diseases like viral hepatitis and HIV. The focus of our translational investigations is the exact understanding and characterization of the virus-specific T cell response of these diseases and of individual patients (“from bed to bench”). The group consists of both biologists and PhD students as well as MDs and MD students. Funding is provided by a broad range of organizations (DFG SFB841+SFB1328), German Center for Infection (DZIF), EU and AmfAR, altogether reflecting the breadth of the different topics and diseases studied in this group in a collaborative way.
We are employing a number of different state of the art methods like multicolor flow cytometry, intracellular cytokine staining, MHC class I +II tetramer staining, ELISpot-assays, PCR and cell cultures to understand the molecular mechanisms of viral chronicity in patient blood and tissue samples (eg. liver biopsies and intestinal mucosa). Overall, we see that the virus-specific immune response is blunted in many cases by expression of co-inhibitory molecules and pathways in patients with chronic disease and are trying to find novel avenues to re-invigorate the antiviral immune response.
As translational immunological group we take part in several clinical vaccine and immune interventional studies.
List of ongoing research projects:Autoimmunology-related projects:
- The role of ectonucleotidases in patients with Graft-versus-Host disease (GvHD) and inflammatory bowel disease (IBD)
HIV-related projects:HIV-related projects:
- Icistem project
- European HIV vaccine alliance
- Studies of the viral reservoir in HIV infection / finding the needle in the haystack
- Shock and kill strategy to eliminate latently infected cells
- Gammadelta Regulatory T cells in HIV Infection
- Ex vivo characterization of coinhibitory molecules on MHC class II tetramer positive HCV-specific T cells in HCV infection
- Specific T cells in Malaria
- The role of ectonucleotidases in patients with Graft-versus-Host disease (GvHD) and inflammatory bowel disease (IBD)
-
AG Giannou: Mechanisms controlling Metastasis
General Information
In our lab, we study the interaction among cancer, stroma and immune cells with the long-term aim of enabling future therapies to prevent or treat metastasis formation. Our team has expertise on cancer and related metastasis. By using transgenic mice combined with metastasis models and state-of-the art microsurgical techniques (e.g., trachea, lung, liver and intestine transplantation in mouse and rat models) we aim to understand how target metastasis organ microenvironment can be modulated to prevent or treat metastasis and to study complex cellular mechanisms directly in vivo, such as the emergence and function of tissue-resident immune cells. Finally, we use human samples isolated from patients suffering from metastasis in order to be able to translate our findings into the human condition.
Key methods-technologies available in the lab:
- Conditional Knock out mouse models
- Culture of colon organoids carrying specific mutations
- Forced models of liver and lung metastasis
- Spontaneous models of liver and lung metastasis
- Organ Transplantation (Orthotopic single left lung, liver, trachea and small intestine transplantation)
- Models of liver and lung carcinogenesis
- In vitro and in vivo transmigration assays of cancer cells
- Extravasation assays
- Isolation of lung and live endothelial cells and in vitro and in vivo endothelial assays
- Germ-free facility
- Single Cell RNA seq
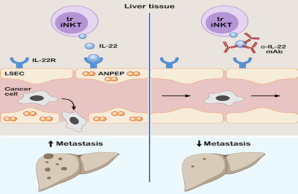
Figure 1. Graphical abstract summarizing the role of iNKT17 cell-derived IL-22 in regulating vascular endothelium and thereby promoting cancer cell extravasation and liver metastasis formation. Tissue resident iNKT17 cell derived IL-22 is promoting the early extravasation of CRC cancer cells into the liver parenchyma by increasing the permeability of the endothelium via ANPEP (Giannou et al., Immunity, 2023).
Selected publications
Giannou AD#, Kempski J#, Shiri AM#, Lücke J, Zhang T, Zhao L, Zazara DE, Cortesi F, Riecken K, Amezcua Vesely MC, Low JS, Xu H, Kaffe E, Garcia-Perez L, Agalioti T, Yamada Y, Jungraithmayr W, Zigmond E, Karstens KF, Steglich B, Wagner J, Konczalla L, Carambia A, Schulze K, von Felden J, May P, Briukhovetska D, Bedke T, Brockmann L, Starzonek S, Lange T, Koch C, Riethdorf S, Pelczar P, Böttcher M, Sabihi M, Huber FJ, Reeh M, Grass JK, Wahib R, Seese H, Stüben BO, Fard-Aghaie M, Duprée A, Scognamiglio P, Plitzko G, Meiners J, Soukou S, Wittek A, Manthey C, Maroulis IC, Arck PC, Perez D, Gao B, Zarogiannis SG, Strowig T, Pasqualini R, Arap W, Gosálvez JS, Kobold S, Prinz I, Guse AH, Tachezy M, Ghadban T, Heumann A, Li J, Melling N, Mann O, Izbicki JR, Pantel K, Schumacher U, Lohse AW, Flavell RA, Gagliani N, Huber S. Tissue resident iNKT17 cells facilitate cancer cell extravasation in liver metastasis via interleukin-22. Immunity 2023;56:125-142.e12. doi:10.1016/ j.immuni.2022.12.014.
Tintelnot J, Xu Y, Lesker TR, Schönlein M, Konczalla L, Giannou AD, Pelczar P, Kylies D, Puelles VG, Bielecka AA, Peschka M, Cortesi F, Riecken K, Jung M, Amend L, Bröring TS, Trajkovic-Arsic M, Siveke JT, Renné T, Zhang D, Boeck S, Strowig T, Uzunoglu FG, Güngör C, Stein A, Izbicki JR, Bokemeyer C, Sinn M, Kimmelman AC, Huber S#, Gagliani N#. Microbiota-derived 3-IAA influences chemotherapy efficacy in pancreatic cancer. Nature 2023; Mar;615(7950):168-174. doi: 10.1038/s41586-023-05728-y. Epub 2023 Feb 22.
Giannou AD#, Kempski J#, Zhang T#, Lücke J#, Shiri AM, Zazara DE, Belios I, Machicote A, Seeger P, Agalioti T, Tintelnot J, Sagebiel A, Tomczak M, Bauditz L, Bedke T, Kocheise L, Mercanoglu B, Fard-Aghaie M, Giorgakis E, Lykoudis PM, Pikouli A, Grass JK, Wahib R, Bardenhagen J, Brunswig B, Heumann A, Ghadban T, Duprée A, Tachezy M, Melling N, Arck PC, Stringa P, Gentilini MV, Gondolesi GE, Nakano R, Thomson AW, Perez D, Li J, Mann O, Izbicki JR, Gagliani N, Maroulis IC#, Huber S#. IL-22BP controls the progression of liver metastasis in colorectal cancer. Front Oncol 2023; May 31;13:1170502. doi: 10.3389/fonc.2023.1170502. eCollection 2023.
Lücke J#, Nawrocki M#, Schnell J, Meins N, Heinrich F, Zhang T, Bertram F, Sabihi M, Böttcher M, Blankenburg T, Pfaff M, Notz S, Kempski J, Reeh M, Wolter S, Mann O, Izbicki JR, Lütgehetmann M, Duprée A, Giannou AD#, Ondruschka B#, Huber S#. TNFα aggravates detrimental effects of SARS-CoV-2 infection in the liver. Front Immunol 2023; Mar 31;14:1151937. doi: 10.3389/fimmu.2023.1151937. eCollection 2023.
Zhao L#, Giannou AD#, Xu Y#, Shiri AM, Liebold I, Steglich B, Bedke T, Zhang T, Lücke J, Scognamiglio P, Kempski J, Woestemeier A, Chen J, Agalioti T, Zazara DE, Lindner D, Janning M, Hennigs JK, Jagirdar RM, Kotsiou OS, Zarogiannis SG, Kobayashi Y, Izbicki JR, Ghosh S, Rothlin CV, Bosurgi L#, Huber S#, Gagliani N#. Efferocytosis fuels malignant pleural effusion through TIMP1. Sci Adv 2021;7:eabd6734. doi:10.1126/sciadv.abd6734.
Zhao L#, Giannou AD#, Xu Y#, Shiri AM, Liebold I, Steglich B, Bedke T, Zhang T, Lücke J, Scognamiglio P, Kempski J, Woestemeier A, Chen J, Agalioti T, Zazara DE, Lindner D, Janning M, Hennigs JK, Jagirdar RM, Kotsiou OS, Zarogiannis SG, Kobayashi Y, Izbicki JR, Ghosh S, Rothlin CV, Bosurgi L#, Huber S#, Gagliani N#. Efferocytosis fuels malignant pleural effusion through TIMP1. Sci Adv 2021;7:eabd6734. doi:10.1126/sciadv.abd6734.
Kempski J#, Giannou AD#, Riecken K, Zhao L, Steglich B, Lücke J, Garcia-Perez L, Karstens KF, Wöstemeier A, Nawrocki M, Pelczar P, Witkowski M, Nilsson S, Konczalla L, Shiri AM, Kempska J, Wahib R, Brockmann L, Huber P, Gnirck AC, Turner JE, Zazara DE, Arck PC, Stein A, Simon R, Daubmann A, Meiners J, Perez D, Strowig T, Koni P, Kruglov AA, Sauter G, Izbicki JR, Guse AH, Roesch T, Lohse AW, Flavell RA, Gagliani N#, Huber S#. IL22BP Mediates the Antitumor Effects of Lymphotoxin Against Colorectal Tumors in Mice and Humans. Gastroenterology 2020;159:1417-30. doi:10.1053/j.gastro.2020.06.033. Epub 2020 Jun 22.
Kanellakis NI#, Giannou AD#, Pepe MAA#, Agalioti T, Zazara DE, Giopanou I, Psallidas I, Spella M, Marazioti A, Arendt KAM, Lamort AS, Champeris Tsaniras S, Taraviras S, Papadaki H, Lilis I#, Stathopoulos GT#. Tobacco chemical-induced mouse lung adenocarcinoma cell lines pin the prolactin orthologue proliferin as a lung tumour promoter. Carcinogenesis 2019;Nov 25;40(11):1352-1362. doi:10.1093/carcin/bgz047.
Kleinschmidt D#, Giannou AD#, McGee HM, Kempski J, Steglich B, Huber FJ, Ernst TM, Shiri AM, Wegscheid C, Tasika E, Hübener P, Huber P, Bedke T, Steffens N, Agalioti T, Fuchs T, Noll J, Lotter H, Tiegs G, Lohse AW, Axelrod JH, Galun E, Flavell RA, Gagliani N, Huber S. A Protective Function of IL-22BP in Ischemia Reperfusion and Acetaminophen-Induced Liver Injury. J Immunol 2017;199:4078-90. doi:10.4049/jimmunol.1700587. Epub 2017 Nov 6.
Agalioti T#, Giannou AD#, Krontira AC#, Kanellakis NI, Kati D, Vreka M, Pepe M, Spella M, Lilis I, Zazara DE, Nikolouli E, Spiropoulou N, Papadakis A, Papadia K, Voulgaridis A, Harokopos V, Stamou P, Meiners S, Eickelberg O, Snyder LA, Antimisiaris SG, Kardamakis D, Psallidas I, Marazioti A, Stathopoulos GT. Mutant KRAS promotes malignant pleural effusion formation. Nat Commun 2017;8:15205. doi:10.1038/ncomms15205.
Giannou AD#, Marazioti A#, Kanellakis NI#, Giopanou I#, Lilis I, Zazara DE, Ntaliarda G, Kati D, Armenis V, Giotopoulou GA, Krontira AC, Lianou M, Agalioti T, Vreka M, Papageorgopoulou M, Fouzas S, Kardamakis D, Psallidas I, Spella M#, Stathopoulos GT#. NRAS destines tumor cells to the lungs. EMBO Mol Med 2017;9:672-86. doi:10.15252/emmm.201606978.
Giannou AD, Marazioti A, Spella M, Kanellakis NI, Apostolopoulou H, Psallidas I, Prijovich ZM, Vreka M, Zazara DE, Lilis I, Papaleonidopoulos V, Kairi CA, Patmanidi AL, Giopanou I, Spiropoulou N, Harokopos V, Aidinis V, Spyratos D, Teliousi S, Papadaki H, Taraviras S, Snyder LA, Eickelberg O, Kardamakis D, Iwakura Y, Feyerabend TB, Rodewald HR, Kalomenidis I, Blackwell TS, Agalioti T, Stathopoulos GT. Mast cells mediate malignant pleural effusion formation. J Clin Invest. 2015 Jun;125(6):2317-34. doi: 10.1172/JCI79840. Epub 2015 Apr 27.
#equally contributing authors
Principal Investigator
Anastasios Giannou, NP, MD, MSc, PhD.
PostDoc
- Tao Zhang, MD
Clinician Scientists
- Jöran Lücke
- Philipp Seeger
PhD students
- Siwen Zhang
- Eleftherios Papazoglou
MD students
- Lennart Bauditz, cand. med.
Technician
- Tom Blankenburg, MTA
Funding
Anastasios Giannou is funded by: Deutsche Krebshilfe, DFG (RU 5068), Erich und Gertrud Roggenbuck-Stiftung, Else Kröner Fresenius Stiftung, Fritz Thyssen Stiftung, German Academic Exchange Service (DAAD), Hamburger Krebsgesellschaft e.V., JUNG-Stiftung, Monika Kutzner Stiftung, UKE, Werner-Otto-Stiftung (alphabethical order).
-
AG Bosurgi: Macrophage-dependent immune modulation in infections and immune-mediated diseases
General information
Our laboratory focuses on studying the mechanisms that regulate macrophage responses during infections or in response to sterile damage. Specifically, our work centers on dissecting the impact of phagocytosis of dying cells, a key function carried out by macrophages in every tissue of our body, on their capacity to trigger tissue remodeling. Our data indeed indicate that phagocytosis of dying cells by macrophages is not merely a cleaning process but significantly influences macrophage behavior. Based on these findings, we are examining tissue-specific factors contributing to the transcriptional and functional heterogeneity of phagocytic macrophages in various contexts, including homeostasis, infection with the parasite Schistosoma mansoni, and in murine models of colitis, inflammation-driven cancer, autoimmune liver diseases and upon metabolic challenges. In all of these scenarios, we have access to human tissues to implement our discoveries, thanks to our affiliation with the I. Department of Medicine at the UKE and our guest associate position at the Bernhard Notch Institute for Tropical Medicine.
By delving deep into the mechanisms of how macrophages engage in phagocytosis and the resulting implications on tissue homeostasis, immune responses, and disease progression, we aim to contribute to the development of innovative strategies that can improve the treatment and management of various diseases.
List of ongoing research projects
- The impact of apoptotic cell nature on macrophage function
- Phagocytic macrophage control of cholangitis progression
- The paradoxical role of IL-23 released by phagocytic macrophages in the damaged liver
- Dying cell-derived extracellular vesicles and their impact on macrophage behavior
- Lipid processing and phagocytic capacity of adipose tissue macrophages
Selected Publications
Staufer T, Körnig C, Liu B, Liu Y, Lanzloth C, Schmutzler O, Bedke T, Machicote A, Parak WJ, Feliu N, Bosurgi L, Huber S, Grüner F. Enabling X-ray fluorescence imaging for in vivo immune cell tracking. Sci Rep 2023 Jul 17;13(1):11505.
Dörk R, Pelczar P, Shiri AM, Volmari A, Zierz E, Giannou A, Böttcher M, Bosurgi L, Huber S, Manthey CF. Myeloid cell specific deletion of PDGFR-α promotes dysbiotic intestinal microbiota and thus increased colitis susceptibility. J Crohns Colitis 2023 Jun 28;jjad103.
Liebold I, Meyer S, Heine M, Kuhl A, Witt J, Eissing L, Fischer AW, Koop AC, Kluwe J, Wiesch JSZ, Wehmeyer M, Knippschild U, Scheja L, Heeren J, Bosurgi L#, Worthmann A#. TREM2 Regulates the Removal of Apoptotic Cells and Inflammatory Processes during the Progression of NAFLD. Cells. 2023 Jan 17;12(3):341.
Zhao L*, Giannou AD*, Xu Y*, Shiri AM, Liebold I, Steglich B, Bedke T, Zhang T, Lücke J, Scognamiglio P, Kempski J, Woestemeier A, Chen J, Agalioti T, Zazara DE, Lindner D, Janning M, Hennigs JK, Jagirdar RM, Kotsiou OS, Zarogiannis SG, Kobayashi Y, Izbicki JR, Ghosh S, Rothlin CV, Bosurgi L#, Huber S#, Gagliani N#. Efferocytosis fuels malignant pleural effusion through TIMP1. Sci Adv. 2021 Aug 13; 7(33):eabd6734.
Liebold I, Jawazneh AA, Hamley M, Bosurgi L. Apoptotic cell signals and heterogeneity in macrophage function: Fine-tuning for a healthy liver. Semin Cell Dev Biol. 2021 Nov;119:72-81.
Zhao Y*, Kilian C*, Turner JE*, Bosurgi L*, Roedl K*, Bartsch P, Gnirck AC, Cortesi F, Schultheiß C, Hellmig M, Enk LUB, Hausmann F, Borchers A, Wong MN, Paust HJ, Siracusa F, Scheibel N, Herrmann M, Rosati E, Bacher P, Kylies D, Jarczak D, Lütgehetmann M, Pfefferle S, Steurer S, Zur-Wiesch JS, Puelles VG, Sperhake JP, Addo MM, Lohse AW, Binder M, Huber S, Huber TB, Kluge S, Bonn S, Panzer U, Gagliani N#, Krebs CF#. Clonal expansion and activation of tissue-resident memory-like Th17 cells expressing GM-CSF in the lungs of severe COVID-19 patients. Sci Immunol 2021; 6:eabf6692.
de Freitas E Silva R, Gálvez RI, Pereira VRA, de Brito MEF, Choy SL, Lotter H, Bosurgi L, Jacobs T. Programmed Cell Death Ligand (PD-L)-1 Contributes to the Regulation of CD4 + T Effector and Regulatory T Cells in Cutaneous Leishmaniasis. Front Immunol. 2020 Oct 22; 11:574491.
Bosurgi L*, Hughes LD*, Rothlin CV, Ghosh S. Death begets a new beginning. Immunol Rev. 2017 Nov;280(1):8-25.
Bosurgi L, Cao YG, Cabeza-Cabrerizo M, Tucci A, Hughes LD, Kong Y, Weinstein JS, Licona-Limon P, Schmid ET, Pelorosso F, Gagliani N, Craft JE, Flavell RA, Ghosh S, Rothlin CV. Macrophage function in tissue repair and remodeling requires IL-4 or IL-13 with apoptotic cells. Science. 2017; 356(6342):1072-1076.
Spadaro O, Camell CD, Bosurgi L, Nguyen KY, Youm YH, Rothlin CV, Dixit VD. IGF1 Shapes Macrophage Activation in Response to Immunometabolic Challenge. Cell Rep. 2017 Apr 11;19(2):225-234.
*equally contributing authors
Principal Investigator
Lidia Bosurgi, PhD
PostDoc
Dr. rer. nat. Imke Liebold
PhD students
- Stephanie Leyk, Ph.D. candidate
- Simon Meyer, Ph.D. candidate
- Clarissa Lanzloth, Ph.D. candidate
Previous lab members
- Dr. rer. nat. Madeleine Hamley
- Dr. rer. nat. Amirah Al Jawazneh
- Dr. med. Felix Piecha, Clinician Scientist
- Benjamin Kruft, MSc
-
AG Adlung: Adipose Systems Biology
You can find more information here .
Infektionsimmunologie
-
AG Hölzemer: Infection and Immune Regulation
General information and list of ongoing projects
General information:
We study how nonclassical HLA-I molecules affect antiviral responses and HIV-induced inflammation of the central nervous system in 3D-organoid models and with functional analysis of human immune cell subsets.
By presenting viral protein on the surface of infected cells, classical Human leukocyte antigen class I (HLA-I) molecules activate antiviral responses while maintaining self-tolerance under healthy conditions. Nonclassical HLA-I molecules (HLA-F, HLA-E and HLA-G) shape innate and adaptive immune responses in mechanisms distinct from antigen presentation. We study how nonclassical HLA-I molecules are regulated under inflammatory conditions and during viral infection, focusing on the Human Immunodeficiency Virus (HIV). We further investigate how nonclassical HLA-I molecules modulate the function of cytotoxic effector cells such as natural killer cells and CD8+ T cells in the peripheral blood and in the highly tolerogenic environment of the liver. Here, tolerance mechanisms can result in ineffective antiviral and antitumor immune responses, but are essential to prevent autoimmune liver disease. For our studies, we focus on human culture systems such as 3D-hepatic organoid models and functional investigation of human immune cell subsets from patient cohorts and healthy individuals.
Ongoing immune inflammation predisposes HIV-1 infected individuals to the development of HIV-1 associated neurodegeneration. As a second line of research, we investigate inflammation in the central nervous system driven by HIV-1 infection. HIV-1 infection of macrophages and microglia is studied in human induced pluripotent stem cell-derived cerebral organoids. This neuro-immune 3D-culture model consists of neurons and glial cells and enables us to investigate the direct link between activated microglia and neuronal damage.
List of ongoing research projects:
- Natural killer cell regulation of T cells in HIV-1 infection
- Microglia in HIV-1 associated neurodegeneration
- The role of HLA-F in liver inflammation and infection
- Nonclassical HLA-I (HLA-F and HLA-E)-dependent immune responses in HIV-1
Group Members:
- Dr. Leonore Mensching (Post-Doc)
- Sébastien Brias (PhD student)
- Timo Trenkner (PhD student)
- Janet I. Akko (cand. med.)
- Thomas van Stigt Thans (cand. med.)
- Maya Beiersdorfer (cand. med.)
Selected Publications:
2021
Koyro TF, Kraus E, Lunemann S, Hölzemer A, Wulf S, Jung J, Fittje P, Henseling F, Körner C, Huber TB, Grundhoff A, Wiech T, Panzer U, Fischer N, Altfeld M. Upregulation of HLA-F expression by BK polyomavirus infection induces immune recognition by KIR3DS1-positive natural killer cells. Kidney Int 2021;99:1140-8.
Graf LM, Rosenkranz SC, Hölzemer A, Hagel C, Goebell E, Jordan S, Friese MA, Addo MM, Schulze Zur Wiesch J, Beisel C. Clinical Presentation and Disease Course of 37 Consecutive Cases of Progressive Multifocal Leukoencephalopathy (PML) at a German Tertiary-Care Hospital: A Retrospective Observational Study. Front Neurol 2021;12:632535.
2019
van Stigt Thans T*, Akko JI*, Niehrs A, Garcia-Beltran WF, Richert L, Stürzel CM, Ford CT, Li H, Ochsenbauer C, Kappes JC, Hahn BH, Kirchhoff F, Martrus G, Sauter D, Altfeld M, Hölzemer A. Primary HIV-1 Strains Use Nef To Downmodulate HLA-E Surface Expression. J Virol 2019;93:e00719-19.
Niehrs A, Garcia-Beltran WF, Norman PJ, Watson GM, Hölzemer A, Chapel A, Richert L, Pommerening-Röser A, Körner C, Ozawa M, Martrus G, Rossjohn J, Lee JH, Berry R, Carrington M, Altfeld M. A subset of HLA-DP molecules serve as ligands for the natural cytotoxicity receptor NKp44. Nat Immunol 2019;20:1129-37.
2018
Lunemann S, Schöbel A, Kah J, Fittje P, Hölzemer A, Langeneckert AE, Hess LU, Poch T, Martrus G, Garcia-Beltran WF, Körner C, Ziegler AE, Richert L, Oldhafer KJ, Schulze Zur Wiesch J, Schramm C, Dandri M, Herker E, Altfeld M. Interactions Between KIR3DS1 and HLA-F Activate Natural Killer Cells to Control HCV Replication in Cell Culture. Gastroenterology 2018;155:1366-71.
2017
Hölzemer A, Garcia-Beltran WF, Altfeld M. Natural Killer Cell Interactions with Classical and Non-Classical Human Leukocyte Antigen Class I in HIV-1 Infection. Front Immunol 2017;8:1496.
Körner C, Simoneau CR, Schommers P, Granoff M, Ziegler M, Hölzemer A, Lunemann S, Chukwukelu J, Corleis B, Naranbhai V, Kwon DS, Scully EP, Jost S, Kirchhoff F, Carrington M, Altfeld M. HIV-1-Mediated Downmodulation of HLA-C Impacts Target Cell Recognition and Antiviral Activity of NK Cells. Cell Host Microbe 2017;22:111-9.e4.
Dulberger CL, McMurtrey CP, Hölzemer A, Neu KE, Liu V, Steinbach AM, Garcia- Beltran WF, Sulak M, Jabri B, Lynch VJ, Altfeld M, Hildebrand WH, Adams EJ. Human Leukocyte Antigen F Presents Peptides and Regulates Immunity through Interactions with NK Cell Receptors. Immunity. 2017;46:1018-29.e7.
2016
Lunemann S, Martrus G, Hölzemer A, Chapel A, Ziegler M, Körner C, Garcia Beltran W, Carrington M, Wedemeyer H, Altfeld M. Sequence variations in HCV core-derived epitopes alter binding of KIR2DL3 to HLA-C∗03:04 and modulate NK cell function. J Hepatol 2016;65:252-8.
Garcia-Beltran WF, Hölzemer A, Martrus G, Chung AW, Pacheco Y, Simoneau CR, Rucevic M, Lamothe-Molina PA, Pertel T, Kim TE, Dugan H, Alter G, Dechanet- Merville J, Jost S, Carrington M, Altfeld M. Open conformers of HLA-F are high- affinity ligands of the activating NK-cell receptor KIR3DS1. Nat Immunol 2016;17:1067-74.
2015
Hölzemer A*, Thobakgale CF*, Jimenez Cruz CA, Garcia-Beltran WF, Carlson JM, van Teijlingen NH, Mann JK, Jaggernath M, Kang SG, Körner C, Chung AW, Schafer JL, Evans DT, Alter G, Walker BD, Goulder PJ, Carrington M, Hartmann P, Pertel T, Zhou R, Ndung'u T, Altfeld M. Selection of an HLA-C*03:04-Restricted HIV-1 p24 Gag Sequence Variant Is Associated with Viral Escape from KIR2DL3+ Natural Killer Cells: Data from an Observational Cohort in South Africa. PLoS Med 2015;12:e1001900; discussion e1001900.
2014
van Teijlingen NH*, Hölzemer A*, Körner C, García-Beltrán WF, Schafer JL, Fadda L, Suscovich TJ, Brander C, Carrington M, Evans DT, van Baarle D, Altfeld M. Sequence variations in HIV-1 p24 Gag-derived epitopes can alter binding of KIR2DL2 to HLA-C*03:04 and modulate primary natural killer cell function. AIDS 2014;28:1399-408.
*equally contributing authors
Virushepatitis-Infektionen
-
AG Dandri: Virushepatitis
Virushepatitis
Häufigster und wichtigster Auslöser einer Leberschädigung sind Infektionserreger, wobei Hepatitisviren eine zentrale Rolle spielen. Weltweit sind fast 500 Millionen Menschen chronisch mit Hepatitis-B-, D- und C-Viren infiziert. Langfristig führt dies zu einem erhöhten Risiko, an Lebezirrhose und an einem hepatozellulären Karzinom zu erkranken. Das Forschungsfeld der viralen Hepatitis wurde durch das Fehlen geeigneter Zellkultursysteme und Tiermodelle stark limitiert. Unsere Arbeitsgruppe benutzt ein einzigartiges Transplantationsmodell, das auf der Repopulierung der Mausleber mit fremden Hepatozyten basiert. Als Empfängertiere dienen Mäuse, bei denen aufgrund eines leberzell-toxisch wirkenden Transgens (uPA: Uroplasminogenaktivator) endogene Maushepatozyten zu Grunde gehen. Dies ermöglicht eine fast komplette Rekonstitution der Mausleber mit menschlichen Leberzellen. Das dauerhafte Überleben der transplantierten Fremd-Hepatozyten wird durch das Einkreuzen immundefizienter Mäusen (SCID/beige oder SCID/IL2γr) erreicht, sodass keine Abstoßungsreaktionen stattfinden können. Diese "humanisierten" Mäuse können nun mit humanen Hepatitisviren (HBV, HDV, HCV und HEV) infiziert werden (Fig.1), worauf es zu einer persistierenden Virämie kommt, die der natürlichen viralen Infektion beim Menschen vergleichbar ist. Durch die Nutzung dieses Modells können wir erstmalig den kompletten Replikationszyklus dieser Viren in vivo untersuchen, sowie die Wirksamkeit verschiedener, sich in der Entwicklung befindlicher antiviraler Medikamente testen.
Forschungsschwerpunkt
- Präklinische Studien um verbesserte Behandlungsmethoden zu entwickeln (Testung neuer Medikamente)
- Molekulare Mechanismen der HBV- und HDV-Persistenz
- Interaktionen zwischen humanen hepatotropen Viren (HBV, HDV, HCV, HEV) und der humanen angeborenen Immunantwort (das heißt Interferon-Signalwege)
Themenbereich HBV (Projektleiterin: Prof. Dr. Maura Dandri)
Die bisherigen Heilungsraten durch antivirale Therapie mit Inhibitoren der HBV-Replikation (Nukleosidanaloga) oder mit Interferon sind leider gering. Ursächlich ist die fehlende direkte therapeutische Beeinflussbarkeit der im Zellkern von Hepatozyten vorliegenden Form des HBV-Virus, der sog. "covalently closed circular" DNA (cccDNA). Die cccDNA spielt eine zentrale Rolle im HBV-Replikationszyklus, indem sie als ständige Matrize zur Replikation neuer Viruspartikel dient. Mithilfe dieses Maussystems können nun neue antivirale Substanzen getestet werden. So wurde in Zusammenarbeit mit Prof. S. Urban (Heidelberg) der therapeutische Effekt einer Eintrittsblockade auf die HBV-Infektion untersucht und gezeigt, dass der Eintrittshemmer Myrcludex-B in der Lage ist, auch während einer bereits erfolgten Infektion die weitere Ausbreitung der Viren zu blockieren (Volz, J. Hepatology 2013). Das Projekt "Entry inhibition as a novel antiviral concept for hepatotropic viruses" wird vom BMBF (DZIF TTU-Hepatitis 05.804) gefördert. Die präklinische Testung neuerer antiviraler Substanzen in "humanisierten" Mäusen wird auch durch Kooperationen mit internationalen Institutionen und mit der Industrie durchgeführt.
Im Rahmen des SFB841 (A5: Molecular mechanisms of HBV persistence in chronically infected uPA chimeric mice) untersuchen wir die molekularen Mechanismen der HBV-Persistenz. Insbesondere gehen wir der Frage nach, wodurch die Aktivität der HBV-Matrize, das cccDNA-Molekül, modifiziert wird und welche Rolle die intrahepatische angeborene Immunantwort spielt. Mithilfe innovativer molekularer Methoden und in Zusammenarbeit mit Prof. M. Levrero (Univ. Rome) und Prof. U. Protzer (München) konnten wir zeigen, wie bestimmte Faktoren und therapeutische Zytokine (z.B. IFNα) die Aktivität (Belloni et al.J. Clin.Invest. 2012; Allweiss et al. J. Hepatology 2014) und die Stabilität (Lucifora et al. Science 2014) des viralen cccDNA Minichromosoms beeinflussen können. Beides hat zur Folge, dass die DNA teilweise stillgelegt oder sogar degradiert wird. Um die Interaktionen zwischen angeborener und adaptiver Immunantwort zu untersuchen, sollen uPA Mäuse auch partiell mit humanen Immunzellen rekonstituiert werden. Wir sind fest überzeugt, dass ein besseres Verständnis der HBV-Wirts-Interaktionen die Entwicklung wesentlich effektiverer Therapien ermöglich wird.
Themenbereich HDV (Projektleiter/in: Dr. Marc Lütgehetmann und Prof. Dr. Maura Dandri)
Von den 300 Millionen Menschen, die weltweit chronisch mit HBV infiziert sind, haben circa 5% ebenfalls eine Infektion mit dem Hepatitis-D-Virus (HDV). Weil HDV nur mit Hilfe des HBV-Oberflächenproteins die infizierten Zellen verlassen kann, kann es sich auch nur in Verbindung mit einer HBV-Infektion vermehren. Im chronischen Stadium einer HBV/HDV-Koinfektion zeigen die Betroffenen einen Krankheitsverlauf, der im Vergleich zu einer alleinigen HBV-Infektion schneller zur Leberzirrhose führen kann. Wir konnten zeigen, dass die chimären Lebern der HBV-infizierten Mäuse auch mit HDV superinfiziert oder ko-infiziert werden können (Lütgehetmann, Hepatology 2012). im Rahme des SFB841 (A8: Hepatitis-D-Virus-induzierte Pathogenese und Interaktion mit dem angeborenen Immunsystem) untersuchen wir Interaktionen zwischen HBV und HDV und dem humanen angeborenen Immunsystem sowie die virus-induzierte Pathogenese im Laufe einer Infektion mit HDV in humanisierten uPA-Mäusen.
Kontakt, Ansprechpartner und Mitarbeiter
Projektleiterin: Prof. Dr. rer. nat. Maura Dandri
Dr. med. Marc Lütgehetmann
Dr. rer. nat. Tassilo Volz
Dr. rer. nat. Lena Allweiss
Dr. rer. nat. Katja Giersch
Dr. rer. nat. Janine Kah
Dr. med. Jan-Hendrik Bockmann
Oliver Daniel Bhadra, Medizin Student, Grad. Kolleg (GRK841)
Sebastian Luft, Medizin Student, Grad. Kolleg (GRK841)
Aktuelle Kooperationen mit anderen Institutionen/Hochschulen
1) Prof. Dr. Stephan Urban, Department of Infectious Diseases, Molecular Virology, Universitätsklinikum Heidelberg
2) Prof. Dr. Ulrike Protzer, Institute of Virology,Technische Universität München / Helmholtz Zentrum München
3) Prof. Dr. med. Jörg Petersen, IFI Institut für interdisziplinäre Medizin an der Asklepiosklinik St. Georg, Hamburg
4) PD Dr. Jörg-Matthias Pollok, Chirurgisches Zentrum, Universitätsklinikum Bonn
5) PD Dr. Dieter Glebe, Institut für Medizinische Virologie, Justus-Liebig-Universität Gießen
6) Prof. Antonio Bertoletti, Emerging Infectious Diseases Duke-Nus Graduate Medical School, Singapore Institute for Clinical Sciences (A*Star), Singapore
7) Prof. Dr. Teresa Pollicino, Division of Clinical and Molecular Hepatology, University Hospital of Messina, Italy
8) Prof. Dr. Massimo Levrero, Department of Internal Medicine - DMISM, Laboratory of Gene Expression, La Sapienza University, Rome, Italy
9) Prof. Dr. John Murray, School of Mathematics and Statistics, Sydney University, Australien
10) Prof. Dr. Maria Buti, Hepatitis Laboratory, Biochemistry Department Vall d'Hebron Hospital, Barcelona, Spain
11) Prof. Camille Sureau, Laboratoire de Virologie Moléculaire, Institut National de la Transfusion Sanguine (INTS), Paris, France12.
12) Prof. Dr. Thomas Baumert, Institut National de la Santé et de la Recherche Médicale, Unité 1110, Institut de Recherche sur les Maladies Virales et Hépatiques, Strasbourg, France.
Publikationen
1. Giersch K, Allweiss L, Volz T, Helbig M, Bierwolf J, Lohse AW, Pollok JM, Petersen J, Dandri M, Lütgehetmann M. Hepatitis Delta co-infection in humanized mice leads to pronounced induction of innate immune responses in comparison to HBV mono-infection. J Hepatol 2015 Mar 17 doi: 10.1016/j.jhep.2015.03.011. [Epub ahead of print]
2. Mailly L, Xiao F, Lupberger J, Wilson GK, Aubert P, Duong FH, Calabrese D, Leboeuf C, Fofana I, Thumann C, Bandiera S, Lütgehetmann M, Volz T, Davis C, Harris HJ, Mee CJ, Girardi E, Chane-Woon-Ming B, Ericsson M, Fletcher N, Bartenschlager R, Pessaux P, Vercauteren K, Meuleman P, Villa P, Kaderali L, Pfeffer S, Heim MH, Neunlist M, Zeisel MB, Dandri M, McKeating JA, Robinet E, Baumert TF. Clearance of persistent hepatitis C virus infection in humanized mice using a claudin-1-targeting monoclonal antibody. Nat Biotechnol 2015 Mar 23. doi: 10.1038/nbt.3179. [Epub ahead of print]
3. Oehler N, Volz T, Bhadra OD, Kah J, Allweiss L, Giersch K, Bierwolf J, Riecken K, Pollok JM, Lohse AW, Fehse B, Petersen J, Urban S, Lütgehetmann M, Heeren J, Dandri M. Binding of hepatitis B virus to its cellular receptor alters the expression profile of genes of bile acid metabolism. Hepatology 2014 Nov;60(5):1483-93
4. Allweiss L, Volz T, Lütgehetmann M, Giersch K, Bornscheuer T, Lohse AW, Petersen J, Ma H, Klumpp K, Fletcher SP, Dandri M. Immune cell responses are not required to induce substantial hepatitis B virus antigen decline during pegylated interferon-alpha administration. J Hepatol 2014 Mar 60(3):500-7.
5. Giersch K, Helbig M, Volz T, Allweiss L, Mancke LV, Lohse AW, Polywka S, Pollok JM, Petersen J, Taylor J, Dandri M, Lütgehetmann M. Persistent hepatitis D virus mono-infection in humanized mice is efficiently converted by hepatitis B virus to a productive co-infection. J Hepatol 2014 Mar; 60(3):538-44.
6. Lucifora J, Xia Y, Reisinger F, Zhang K, Stadler D, Cheng X, Sprinzl MF, Koppensteiner H, Makowska Z, Volz T, Remouchamps C, Chou WM, Thasler WE, Hüser N, Durantel D, Liang TJ, Münk C, Heim MH, Browning JL, Dejardin E, Dandri M, Schindler M, Heikenwalder M, Protzer U. Specific and nonhepatotoxic degradation of nuclear hepatitis B virus cccDNA Science. 2014 Mar 14;343(6176):1221-8.
7. Volz T, Allweiss L, M Barek MB, Warlich M, Lohse AW, Pollok JM, Alexandrov A, Urban S, Petersen J, Lütgehetmann M, Dandri M. The entry inhibitor Myrcludex-B efficiently blocks intrahepatic virus spreading in humanized mice previously infected with hepatitis B virus. J Hepatol. 2013; 58: 861-7.
8. Belloni L, Allweiss L, Guerrieri F, Pediconi N, Volz T, Pollicino T, Petersen J, Raimondo G, Dandri M, Levrero M. IFNα inhibits HBV transcription and replication in cell culture and in humanized mice by targeting the epigenetic regulation of the nuclear cccDNA minichromosome. J Clin Invest. 2012 Feb 1;122(2):529-37
9. Lütgehetmann M, Mancke LV, Volz T, Helbig M, Allweiss L, Bornscheuer T, Pollok JM, Lohse AW, Petersen J, Urban S, Dandri M. Humanized chimeric uPA mouse model for the study of hepatitis B and D virus interactions and preclinical drug evaluation. Hepatology 2012 Mar;55(3):685-94.
10. Lütgehetmann M, Bornscheuer T, Volz T, Allweiss L, Bockmann JH, Pollok JM, Lohse AW, Petersen J, Dandri M. Hepatitis B Virus Limits Response of Human Hepatocytes to Interferon alpha in Chimeric Mice. Gastroenterology. 2011 Jun;140(7):2074-83.
-
AG Pischke: Hepatitis-E-Virus-Infektionen
Hepatitis E
Hepatitis E, eine Inflammation der Leber, wird durch das Hepatitis-E-Virus (HEV), welches weltweit vorkommt, ausgelöst. Mit in Deutschland 3.700 gemeldeten Fälle von Hepatitis E (2019) stellt diese nach der Hepatitis B und C die dritthäufigste gemeldete Virushepatitis dar. Die anti-HEV-Seroprävalenz in Deutschland liegt bei bis zu 20-30 %. HEV wird in Europa vor allem durch den Verzehr von unzureichend erhitztem Schweinefleisch übertragen, aber auch Bluttransfusionen haben bis Ende 2019 ein relevantes Risiko dargestellt. Seit Januar 2020 werden nun jedoch alle Blutspenden in Deutschland auf HEV getestet. Immunkompromittierte mit HEV-Kontakt haben ein Risiko von circa 50 %, eine chronische Hepatitis E zu entwickeln, was zu einer Leberzirrhose führen kann. HEV- Infektionen wurden zudem mit Erkrankungen verschiedenster Organsysteme, sogenannten extrahepatischen Manifestationen, in Verbindung gebracht.
Forschungsschwerpunkte:
● Epidemiologie und Identifikation von Risikofaktoren der HEV-Infektion
● Klinischer und serologischer Verlauf
● Stellenwert und Pathophysiologie extrahepatischer Manifestationen sowie HEV-spezifische
Antikörper und ImmunantwortThemenbereich "Klinischer und serologischer Verlauf, spezifische Antikörper und Immunantwort" (Projektleiter: PD Dr. Sven Pischke)
Zur Erfassung des klinischen Verlaufs und zur detaillierten Charakterisierung der HEV-Infektion führen wir observationelle Untersuchungen bei Patienten mit zugrundeliegender Lebererkrankung und bei immunkompromittierten Patienten durch, die ein erhöhtes Risiko haben, im Rahmen einer Hepatitis E ein akutes Leberversagen (ALF), ein Akut-auf-Chronisches Leberversagen (ACLF) oder eine chronische Hepatitis E zu entwickeln. Zudem beschäftigen wir uns mit therapeutischen Ansätzen für Patienten, welche auf die aktuell empfohlene (off-label-) Ribavirin-Therapie kein adäquates Ansprechen zeigen.
Themenbereich "Extrahepatische Manifestationen und spezifische Immunantwort" (Projektleiter: PD Dr. Sven Pischke)
HEV-Infektionen werden neben Leberentzündungen auch zunehmend mit anderen Erkrankungen diverser Organe assoziiert. Die Pathophysiologie sowie ein möglicher Kausalzusammenhang dieser „extrahepatischen Manifestationen“ ist noch weitestgehend ungeklärt. Deshalb erfassen wir die Relevanz extrahepatischer Manifestationen von HEV-Infektionen in standardisierter Art und Weise und untersuchen, inwieweit mutmaßliche extrahepatische Manifestationen wie das Guillain-Barré-Syndrom (GBS), die neuralgische Amyotrophie (NA), Myasthenia Gravis (MG), Glomerulonephritis (GN) und Psychosen mit einer überschießenden Immunantwort assoziiert sind.
Die Schädigung der Leber wird mutmaßlich nicht nur durch das Hepatitis-E-Virus selbst, sondern durch eine starke Immunantwort (zytotoxische T-Zellen und Natürliche Killerzellen (NK-Zellen)) verursacht. Die Mechanismen dieser (überschießenden) Immunantwort sind bis dato nur unzureichend geklärt und daher Teil unserer Forschung.
Lebertumoren
-
AG Schulze / von Felden: Hepatocarcinogenesis and molecular risk stratification
Hepatocarcinogenesis and molecular risk stratification
Objective:
Despite the revolution of personalized cancer care and immunotherapy in many other cancer entities, liver cancer has fallen behind regarding biomarker research and personalized medicine. Based on our previous work, our translational research group aims at delineating actionable mechanisms of liver cancer initiation and progression and at establishing molecular risk stratification algorithms. We have the ambitious goal to implement personalized cancer care in this devastating disease, including primary prevention strategies, early cancer detection, improving treatment allocation, and solving therapeutic resistance. We are working both on clinical and translational projects, including wet and dry bench work, and in close collaboration with local and international partners.
Methods / data sets: ·
- Large clinical database (~1,000 patients)
- Large biobank of tissue and blood specimens
- Liquid Biopsy technologies o
- Circulating tumor DNA
- Extracellular vesicles
- Circulating tumor cells
- Next-generation sequencing
- RNAseq (bulk, small RNA, single-cell)
- DNA mutation / methylation profiling ·
- Tissue Microarray
- Metabolomics, Tissue and Serum
- Proteomics
- Clinical trials (all phases)
Principal Investigators
Priv.-Doz. Dr. med. K. Schulze
Priv.-Doz. Dr. med. J. von Felden
Clinician Scientists:
Dr. Thorben Fründt, MD
Dr. Lorenz Kocheise, MD
Dr. Vincent Jörg, MD
associated:
Dr. Jan Kempski, MD
Selected publications:
von Felden J, Garcia-Lezana T, Dogra N, Kozlova E, Ahsen ME, Craig AJ, Gifford S, Wunsch B, Smith JT, Kim S, Diaz JEL, Chen X, Labgaa I, Haber PK, Olsen R, Han D, Restrepo P, D’Avola D, Hernandez-Meza G, Allette K, Sebra R, Saberi B, Tabrizian P, Asgharpour A, Dieterich D, Llovet JM, Cordon-Cardo C, Tewari A, Schwartz M, Stolovitzky G, Losic B, Villanueva A. Unannotated small RNA clusters in circulating extracellular vesicles detect early stage liver cancer. Gut 2021.
Pfister D, Núñez NG, Pinyol R, Govaere O, Pinter M, Szydlowska M, Gupta R, Qiu M, Deczkowska A, Weiner A, Müller F, Sinha A, Friebel E, Engleitner T, Lenggenhager D, Moncsek A, Heide D, Stirm K, Kosla J, Kotsiliti E, Leone V, Dudek M, Yousuf S, Inverso D, Singh I, Teijeiro A, Castet F, Montironi C, Haber PK, Tiniakos D, Bedossa P, Cockell S, Younes R, Vacca M, Marra F, Schattenberg JM, Allison M, Bugianesi E, Ratziu V, Pressiani T, D'Alessio A, Personeni N, Rimassa L, Daly AK, Scheiner B, Pomej K, Kirstein MM, Vogel A, Peck-Radosavljevic M, Hucke F, Finkelmeier F, Waidmann O, Trojan J, Schulze K., Wege H, Koch S, Weinmann A, Bueter M, Rössler F, Siebenhüner A, De Dosso S, Mallm JP, Umansky V, Jugold M, Luedde T, Schietinger A, Schirmacher P, Emu B, Augustin HG, Billeter A, Müller-Stich B, Kikuchi H, Duda DG, Kütting F, Waldschmidt DT, Ebert MP, Rahbari N, Mei HE, Schulz AR, Ringelhan M, Malek N, Spahn S, Bitzer M, Ruiz de Galarreta M, Lujambio A, Dufour JF, Marron TU, Kaseb A, Kudo M, Huang YH, Djouder N, Wolter K, Zender L, Marche PN, Decaens T, Pinato DJ, Rad R, Mertens JC, Weber A, Unger K, Meissner F, Roth S, Jilkova ZM, Claassen M, Anstee QM, Amit I, Knolle P, Becher B, Llovet JM, Heikenwalder M. NASH limits anti-tumour surveillance in immunotherapy-treated HCC. Nature 2021;592:450-56.
Labgaa I*, von Felden J*, Craig AJ, Martins-Filho SN, Villacorta-Martin C, Demartines N, Dormond O, D'Avola D, Villanueva A. Experimental Models of Liquid Biopsy in Hepatocellular Carcinoma Reveal Clone-Dependent Release of Circulating Tumor DNA. Hepatol Commun 2021;5:1095-1105.
von Felden J, Craig AJ, Garcia-Lezana T, Labgaa I, Haber PK, D'Avola D, Asgharpour A, Dieterich D, Bonaccorso A, Torres-Martin M, Sia D, Sung MW, Tabrizian P, Schwartz M, Llovet JM, Villanueva A. Mutations in circulating tumor DNA predict primary resistance to systemic therapies in advanced hepatocellular carcinoma. Oncogene 2021;40:140-51.
von Felden J, Garcia-Lezana T, Schulze K, Losic B, Villanueva A. Liquid biopsy in the clinical management of hepatocellular carcinoma. Gut 2020;69:2025-34.
Craig AJ, von Felden J, Garcia-Lezana T, Sarcognato S, Villanueva A. Tumour evolution in hepatocellular carcinoma. Nat Rev Gastroenterol Hepatol 2020;17:139-52
Hernandez-Meza G*, von Felden J*, Gonzalez-Kozlova EE, Garcia-Lezana T, Peix J, Portela A, Craig AJ, Sayols S, Schwartz M, Losic B, Mazzaferro V, Esteller M, Llovet JM, Villanueva A. DNA Methylation Profiling of Human Hepatocarcinogenesis. Hepatology 2020;10.1002/hep.31659.
Krause J, von Felden J, Casar C, Fründt TW, Galaski J, Schmidt C, Jung C, Ittrich H, Weidemann SA, Krech T, Heumann A, Li J, Fischer L, Sauter G, Lohse AW, Wege H, Schulze K. Hepatocellular carcinoma: Intratumoral EpCAM-positive cancer stem cell heterogeneity identifies high-risk tumor subtype. BMC Cancer 2020;20:1130.
von Felden J, Wege H, Schulze K. Elevated Aspartate Aminotransferase to Alanine Aminotransferase Ratio Predicts Poor Outcome in Hepatocellular Carcinoma. Hepatol Commun 2020;4:1382-83.
Ruiz de Galarreta M, Bresnahan E*, Molina-Sánchez P*, Lindblad KE*, Maier B*, Sia D, Puigvehi M, Miguela V, Casanova-Acebes M, Dhainaut M, Villacorta-Martin C, Singhi AD, Moghe A, von Felden J, Tal Grinspan L, Wang S, Kamphorst AO, Monga SP, Brown BD, Villanueva A, Llovet JM, Merad M, Lujambio A. β-Catenin Activation Promotes Immune Escape and Resistance to Anti-PD-1 Therapy in Hepatocellular Carcinoma. Cancer Discov 2019;9:1124-41
von Felden J, Alric L, Pischke S, Aitken C, Schlabe S, Spengler U, Giordani MT, Schnitzler P, Bettinger D, Thimme R, Xhaard A, Binder M, Ayuk F, Lohse AW, Cornelissen JJ, de Man RA, Mallet V. The burden of hepatitis E among patients with haematological malignancies: A retrospective European cohort study. J Hepatol 2019;71:465-72.
Scheiner B, Kirstein MM, Hucke F, Finkelmeier F, Schulze K, von Felden J, Koch S, Schwabl P, Hinrichs JB, Waneck F, Waidmann O, Reiberger T, Müller C, Sieghart W, Trauner M, Weinmann A, Wege H, Trojan J, Peck-Radosavljevic M, Vogel A, Pinter M. Programmed cell death protein-1 (PD-1)-targeted immunotherapy in advanced hepatocellular carcinoma: efficacy and safety data from an international multicentre real-world cohort. Aliment Pharmacol Ther 2019;49:1323-33.
von Felden J*, Schulze K*, Krech T, Ewald F, Nashan B, Pantel K, Lohse AW, Riethdorf S, Wege H. Circulating tumor cells as liquid biomarker for high HCC recurrence risk after curative liver resection. Oncotarget 2017;8:89978-87.
Weismüller TJ, Trivedi PJ, Bergquist A, Imam M, Lenzen H, Ponsioen CY, Holm K, Gotthardt D, Färkkilä MA, Marschall HU, Thorburn D, Weersma RK, Fevery J, Mueller T, Chazouillères O, Schulze K, Lazaridis KN, Almer S, Pereira SP, Levy C, Mason A, Naess S, Bowlus CL, Floreani A, Halilbasic E, Yimam KK, Milkiewicz P, Beuers U, Huynh DK, Pares A, Manser CN, Dalekos GN, Eksteen B, Invernizzi P, Berg CP, Kirchner GI, Sarrazin C, Zimmer V, Fabris L, Braun F, Marzioni M, Juran BD, Said K, Rupp C, Jokelainen K, Benito de Valle M, Saffioti F, Cheung A, Trauner M, Schramm C, Chapman RW, Karlsen TH, Schrumpf E, Strassburg CP, Manns MP, Lindor KD, Hirschfield GM, Hansen BE, Boberg KM; International PSC Study Group. Patient Age, Sex, and Inflammatory Bowel Disease Phenotype Associate With Course of Primary Sclerosing Cholangitis. Gastroenterology 2017;152:1975-84.e8.
Schulze K, Nault JC, Villanueva A. Genetic profiling of hepatocellular carcinoma using next-generation sequencing. J Hepatol 2016;65:1031-42.
Zenouzi R, Weismüller TJ, Jørgensen KK, Bubenheim M, Lenzen H, Hübener P, Schulze K, Weiler-Normann C, Sebode M, Ehlken H, Pannicke N, Hartl J, Peiseler M, Hübener S, Karlsen TH, Boberg KM, Manns MP, Lohse AW, Schramm C. No Evidence That Azathioprine Increases Risk of Cholangiocarcinoma in Patients With Primary Sclerosing Cholangitis. Clin Gastroenterol Hepatol 2016;14:1806-12.
Schulze K*, Imbeaud S*, Letouzé E*, Alexandrov LB, Calderaro J, Rebouissou S, Couchy G, Meiller C, Shinde J, Soysouvanh F, Calatayud AL, Pinyol R, Pelletier L, Balabaud C, Laurent A, Blanc JF, Mazzaferro V, Calvo F, Villanueva A, Nault JC, Bioulac-Sage P, Stratton MR, Llovet JM, Zucman-Rossi J. Exome sequencing of hepatocellular carcinomas identifies new mutational signatures and potential therapeutic targets. Nat Genet 2015;47:505-11.
Schulze K, Gasch C, Staufer K, Nashan B, Lohse AW, Pantel K, Riethdorf S, Wege H. Presence of EpCAM-positive circulating tumor cells as biomarker for systemic disease strongly correlates to survival in patients with hepatocellular carcinoma. Int J Cancer 2013;133:2165-71.
*equally contributing authors
NET
-
AG Schrader: Tumormikroenvironment
Tumormikroenvironment
Forschungsschwerpunkte
Der Forschungsschwerpunkt der AG Tumormikroenvironment liegt auf der Untersuchung des entzündlichen Tumorstromas bei Tumoren des gastro-intestinal Traktes. Das Tumorstroma setzt sich aus der extrazellulären Matrix, den Tumorstromazellen (Fibroblasten) und infiltrierenden Entzündungszellen zusammen. Ein Schwerpunkt der Untersuchungen ist der Einfluss der pathologisch erhöhten Matrixfestigkeit in Tumoren (Fibrose) auf die Tumorzellen. Es konnte hier bereits eine Stimulation von Wachstum, Ausprägung eines malignen mesenchymalen Phänotyps (EMT) und Verminderung des Chemotherapieansprechens für Tumorzellen in einer festen Matrixumgebung gezeigt werden. Die Entschlüsselung der zugrundeliegenden molekularen Mechanismen ist Gegenstand aktueller Forschungsarbeiten zu diesem Thema. Ein zweiter Schwerpunkt der Untersuchungen zum Tumorstroma betrifft die Kommunikation der Tumorfibroblasten und Tumor-assoziierten Makrophagen mit den Tumorzellen. Es interessiert uns hier welchen Einfluss die Stromazellen auf die Ausprägung eines malignen (mesenchymalen) Phänotyps und das Ansprechen auf Chemotherapie haben. Im Gegenzug wollen wir aber auch verstehen welchen Einfluss die Tumorzellen auf die Stromazellen haben und durch welche Mechanismen/Signalwege ein tumorfördernder Phänotyp in den Stromazellen induziert wird. Die Untersuchungen zum entzündlichen Tumorstroma werden an verschiedenen Tumorentitäten des gastro-intestinal Traktes durchgeführt – insbesondere interessieren uns das hepatozellulären Karzinom (HCC), das duktale Adenokarzinom des Pankreas und das Adenokarzinom des Ösophagus. Es besteht für diesen Forschungsschwerpunkt eine sehr enge Kooperation mit der Klinik für Allgemein-, Viszeral- und Thoraxchirurgie.
Neben dem Tumorstroma bei gastro-intestinalen Karzinomen liegt ein weiterer Forschungsschwerpunkt auf der Untersuchung neuroendokriner Tumore. Aufgrund der Seltenheit dieser Tumorerkrankung ist bisher wenig über die Tumorbiologie bekannt, und es besteht ein dringender Bedarf neue Therapien zu entwickeln. Bisher waren die präklinischen Forschungsbemühungen durch die eingeschränkte Verfügbarkeit von gut-differenzierten neuroendokrinen Zelllinien limitiert. Durch die erfolgreiche Etablierung zweier neuer primärer Tumorzelllinien aus neuroendokrinen Tumoren des Pankreas in unserem Labor, haben wir die Möglichkeit an klinisch-relevanten Tumorzelllinien neue therapeutische Verfahren zu entwickeln und Untersuchungen zum Verständnis der Tumorbiologie dieser Tumore durchzuführen.
Kontakt, Ansprechpartner und Mitarbeiter
Leiter: Priv.-Doz. Dr. med. Schrader
Martina Fahl (MTA)
Corinna Rhotert (MTA)
Publikationen
Bacher M*, Schrader J*, Thompson N, Kuschela K, Gemsa D, Waeber G, Schlegel J. Up-regulation of macrophage migration inhibitory factor gene and protein expression in glial tumor cells during hypoxic and hypoglycemic stress indicates a critical role for angiogenesis in glioblastoma multiforme. Am J Pathol. 2003. 162(1):11-7. *equally contributed
Schrader J, Rennekamp W, Niebergall U, Schoppet M, Jahr H, Brendel MD, Hörsch D, Hofbauer LC. Cytokine induced osteoprotegerin expression protects pancreatic beta cells through p38 MAP kinase signaling against cell death. Diabetologia. 2007. 50(6):1243-7.
Benten D, Keller G, Quaas A, Schrader J, Gontarewicz A, Balabanov S, Braig M, Wege H, Moll J, Lohse AW, Brummendorf TH. Aurora kinase inhibitor PHA-739358 suppresses growth of hepatocellular carcinoma in vitro and in a xenograft mouse model. Neoplasia. 2009. 11(9):934-44.
Schrader J, Deuster O, Rinn B, Schulz M, Kautz A, Dodel R, Meyer B, Al-Abed Y, Balakrishnan K, Reese JP, Bacher M. Restoration of contact inhibition in human glioblastoma cell lines after MIF knockdown. BMC Cancer. 2009. 28;9:464.
Schrader J*, Gordon-Walker TT*, van Deemter M, Aucott RL, Quaas A, Walsh S, Benten D, Forbes SJ, Wells RG, Iredale JP. Matrix stiffness modulates proliferation, chemotherapeutic response and dormancy in hepatocellular carcinoma cells. Hepatology. 2011. 53(4):1192-205. *equally contributed
Schrader J, Iredale J. The inflammatory microenvironment of HCC – The plot becomes complex. J Hepatol. 2011. 54(5):853-5.
Lüth S*, Schrader J*, Zander S, Carambia A, Buchkremer J, Huber S, Reifenberg K, Yamamura KI, Schirmacher P, Lohse AW, Herkel J. Chronic inflammatory IFNgamma-signalling suppresses hepatocarcinogenesis in mice by sensitizing hepatocytes for apoptosis. Cancer Res. 2011. 71(11):3763-71. *equally contributed
Fraedrich K, Schrader J, Ittrich H, Keller G, Gontarewicz A, Matzat V, Kromminga A, Pace A, Moll J, Bläker M, Lohse AW, Hörsch D, Brümmendorf TH, Benten D. Targeting aurora kinases with danusertib (PHA-739358) inhibits growth of liver metastases from gastroenteropancreatic neuroendocrine tumors in an orthotopic xenograft model. Clin Cancer Res. 2012;18(17):4621-32
Schrader J. The role of MDSCs in hepatocellular carcinoma - in vivo veritas? J Hepatol. 2013;59(5):921-3.
Schrader J, Niebel P, Rossi A, Archontidou-Aprin E, Hörsch D. Differential signaling by regulatory subunits of phosphoinositide-3-kinase influences cell survival in INS-1E insulinoma cells. Exp Clin Endocrinol Diabetes 2015;123(3): 118-25
Emerging Infections
-
AG Emerging Infections
Informationen zu den klinischen Studien und der begleitenden Forschung des Institut für Infektionsforschung und Impfstoffentwicklung, unter der Leitung von Frau Prof. Marylyn M. Addo, finden Sie hier: UKE - IIRVD - Institut für Infektionsforschung und Impfstoffentwicklung .
Tropenmedizinische Forschung
-
AG Kreuels
Fall-Kontroll-Studie zu respiratorischen Erregern
Respiratorische Infektionen gehören weltweit zu den häufigsten Ursachen für eine fieberhafte Erkrankung bei Kindern, insbesondere auch im tropischen Afrika. Aktuell wird zur Diagnostik bei schweren respiratorischen Erkrankungen, bei vorhandenen Möglichkeiten, meist eine Multiplex-PCR auf bis zu 15 verschiedene Erreger durchgeführt. Da entsprechende Erreger häufig auch bei Gesunden nachgewiesen werden können, ist die Bedeutung einer positiven Reaktion in diesen Untersuchungen häufig unklar.
Um diese Frage zu klären, führen wir aktuell eine Fall-Kontroll-Studie in einem Krankenhaus in Ghana durch, bei der sowohl von Kindern, die sich wegen eines Atemwegsinfekts in stationärer Behandlung befinden, als auch von Kindern einer gesunden Kontrollgruppe Abstriche des Nasenrachenraumes angefertigt und diese auf insgesamt 20 mögliche bakterielle und virale Erreger untersucht werden. Durch den Vergleich der Prävalenz zwischen den Gruppen wird dann eine Aussage zur klinischen Relevanz der Erreger ermöglicht.Untersuchung der nosokomialen Transmission von Multiresistenten Gram-negativen Erregern
Die weltweit zunehmende Bedeutung von multiresistenten bakteriellen Erregern ist unbestritten. Neben MRSA haben in den letzten Jahren gerade Resistenzen bei gram-negativen Erregern im Darm deutlich zugenommen, allerdings ist die Datenlage zur Prävalenz von Resistenzen in West Afrika sehr dürftig. Studien bei Reisenden zeigen eine vermehrte Akquisition von multiresistenten Erregern bei Reisen nach Asien und Afrika und Daten aus einer früheren Studie bei Kindern in Agogo (Ghana) zeigen eine Prävalenz von bis zu 80% extended spectrum beta lactamase (ESBL) produzierende Klebsiellen in
Blutkulturen.
Daher führen wir zur Zeit eine Studie in einem ghanaischen Krankenhaus durch, in der wir die Prävalenz und nosokomiale Transmission der Besiedelung mit ESBL- und Carbapenemase-produzierenden Bakterien untersuchen.Publikationen
Association Between Malaria and Invasive non-typhoid Salmonella Infection in a Hospital Study – Accounting for Berkson’s Bias. Krumkamp , Kreuels B, Sarpong N, Gyau K, Foli G, Hogan B, Jaeger A, Reigl L, Zeeb H, Marks F, Adu-Sarkodie Y, May J. Clin Infect Dis 2015, In Press
A case of severe Ebola virus infection complicated by gram-negative septicemia. Kreuels B, Wichmann D, Emmerich P, Schmidt-Chanasit J, de Heer G, Kluge S, Sow A, Renné T, Günther S, Lohse AW, Addo MM, Schmiedel S. N Engl J Med. 2014
The causal effect of malaria on stunting: a Mendelian randomization and matching approach. Kang H*, Kreuels B*, Adjei O, Krumkamp R, May J, Small DS. Int J Epidemiol. 2013 *Equally contributed