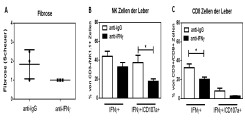Im Rahmen der Klinischen Forschungsgruppe 306 (KFO306) förderte die Deutsche Forschungsgemeinschaft (DFG) von 2016 bis 2023 die I. Medizinische Klinik des UKE bei der Erforschung der Primären Sklerosierenden Cholangitis (PSC).
Die PSC ist eine chronische, vernarbende Erkrankung der Gallengänge in und außerhalb der Leber. Die PSC ist in 2/3 der Fälle mit einer chronisch entzündlichen Darmerkrankung assoziiert. Die Erkrankung befällt vorwiegend junge Erwachsene und führt innerhalb von 10-20 Jahren zur biliären Leberzirrhose, Lebertransplantation oder zum Tod der Patienten durch die Entwicklung hepatobiliärer Malignome. Die Pathogenese der PSC ist unverstanden. Die PSC ist eine der häufigsten Indikationen zur Lebertransplantation, die derzeit die einzige wirksame Therapie dieser progredienten Erkrankung ist.
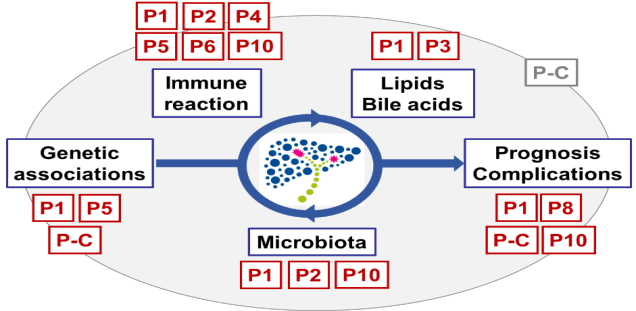
Unsere Klinische Forschungsgruppe hat sich zum Ziel gesetzt, die Pathogenese der PSC aufzuklären, um durch dieses Verständnis neue Therapiemöglichkeiten zu eröffnen. Wir postulieren, dass die Gallengangsentzündung durch eine fehlgeleitete Immunreaktion an der mucosalen Barriere verursacht wird. Wir vertreten die Hypothese, dass das Mikrobiom in der immunologischen und metabolischen Wechselwirkung mit dem Wirt hierbei eine große Rolle spielt. Um diese Interaktionen zu verstehen, werden Wissenschaftler verschiedener Expertise aus Grundlagen- und klinischer Forschung in der KFO306 zusammengeführt. Die Ziele der KFO306 sind die Aufklärung der Immunpathogenese der PSC mit einem Fokus auf das intestinale und biliäre Mikrobiom und die Immunreaktion an der mucosalen Barriere, die Identifikation der pathogenetischen Zusammenhänge zwischen Mikrobiom und dem Gallensäure- und Lipidstoffwechsel sowie der Entzündung in Leber und Colon. Das Ziel ist es, diese Erkenntnisse in in klinische Studien zu übertragen.
Hierzu wurden insgesamt neun Projektgruppen gebildet:
-
Projekt 1: Charakterisierung des intestinalen und biliären Mikrobioms von Patienen mit Primär Sklerosierender Cholangitis (PSC)
Projekt 1
Charakterisierung des intestinalen und biliären Mikrobioms von Patienten mit Primär Sklerosierender Cholangitis (PSC)
In den letzten Jahren wurde deutlich, dass unsere Gesundheit maßgeblich durch die Interaktion mit den uns kolonisierenden Bakterien, Viren, Pilzen und Archaebakterien (die Summe wird als „Mikrobiom“ bezeichnet) geprägt wird. Insbesondere das intestinale Mikrobiom scheint hier durch die Menge der Keime und die enge räumliche Interaktion mit dem mucosalen Immunsystem eine wichtige Rolle einzunehmen. Über das biliäre Mikrobiom hingegen ist bisher sehr wenig bekannt. Da aber, entgegen früherer Annahmen, die Galle gerade bei PSC Patienten nicht steril ist, kommt dem biliären Mikrobiom, das in diesem Projekt untersucht werden soll, vermutlich eine wichtige pathogenetische Bedeutung zu.
In diesem Projekt soll die Charakterisierung des intestinalen und biliären Mikrobioms, sowie der Zusammenhang zwischen Genetik, Metabolismus und Ernährung mit dem Mikrobiom untersucht werden. Gezielt soll der Einfluss der Befunde auf die T-Zelldifferenzierung und den Verlauf der Erkrankung analysiert werden. Über das Verständnis dieser Zusammenhänge sollen neue Therapiemöglichkeiten (z.B. über Ernährungsintervention) für eine Erkrankung eröffnet werden, für die es bisher keine wirksame Therapie gibt.
Projektleitung
 Prof. Dr. med.Christoph Schramm
Prof. Dr. med.Christoph Schramm- Oberarzt
- Helmut und Hannelore Greve Stiftungsprofessur
- Zentrum für Innere Medizin
- I. Medizinische Klinik und Poliklinik (Gastroenterologie mit Sektionen Infektiologie und Tropenmedizin)
- Facharzt für Innere Medizin und Gastroenterologie
Standort
Hauptgebäude O10 , 2. EtageProf. Dr. rer. nat.
Andre Franke
Direktor, Institut für Klinische Molekularbiologie (IKMB), Christian-Albrechts-Universität zu Kiel (CAU), Universitätsklinikum Schleswig Holstein • Campus Kiel, Rosalind-Franklin-Straße. 12, 24105 Kiel
Wissenschaftliche Mitarbeiter
AG Schramm
AG Franke
Aktuelle projektbezogene Publikationen
Poch T, Krause J, Casar C, Liwinski T, Glau L, Kaufmann M, Ahrenstorf AE, Hess LU, Ziegler AE, Martrus G, Lunemann S, Sebode M, Li J, Schwinge D, Krebs CF, Franke A, Friese MA, Oldhafer KJ, Fischer L, Altfeld M, Lohse AW, Huber S, Tolosa E, Gagliani N, Schramm C. Single-cell atlas of hepatic T cells reveals expansion of liver-resident naive-like CD4+ T cells in primary sclerosing cholangitis. J Hepatol 2021;24:S0168-8278(21)00219-1.
Reich M, Spomer L, Klindt C, Fuchs K, Stindt J, Deutschmann K, Höhne J, Liaskou E, Hov JR, Karlsen TH, Beuers U, Verheij J, Ferreira-Gonzalez S, Hirschfield G, Forbes SJ, Schramm C, Esposito I, Nierhoff D, Fickert P, Fuchs CD, Trauner M, García-Beccaria M, Gabernet G, Nahnsen S, Mallm JP, Vogel M, Schoonjans K, Lautwein T, Köhrer K, Häussinger D, Luedde T, Heikenwalder M, Keitel V. Downregulation of TGR5 (GPBAR1) in biliary epithelial cells contributes to the pathogenesis of sclerosing cholangitis. J Hepatol 2021:S0168-8278(21)00244-0.
Stein S, Henze L, Poch T, Carambia A, Krech T, Preti M, Schuran FA, Reich M, Keitel V, Fiorotto R, Strazzabosco M, Fischer L, Li J, Müller LM, Wagner J, Gagliani N, Herkel J, Schwinge D, Schramm C. IL-17A/F enable cholangiocytes to restrict T cell-driven experimental cholangitis by upregulating PD-L1 expression. J Hepatol 2021;74:919-30.
Kummen M, Thingholm LB, Rühlemann MC, Holm K, Hansen SH, Moitinho-Silva L, Liwinski T, Zenouzi R, Storm-Larsen C, Midttun Ø, McCann A, Ueland PM, Høivik ML, Vesterhus M, Trøseid M, Laudes M, Lieb W, Karlsen TH, Bang C, Schramm C, Franke A, Hov JR. Altered Gut Microbial Metabolism of Essential Nutrients in Primary Sclerosing Cholangitis. Gastroenterology 2021;160:1784-1798.e0.
Stein S, Henze L, Poch T, Carambia A, Krech T, Preti M, Schuran FA, Reich M, Keitel V, Fiorotto R, Strazzabosco M, Fischer L, Li J, Müller LM, Wagner J, Gagliani N, Herkel J, Schwinge D, Schramm C. #. IL-17A/F enable cholangiocytes to restrict T cell-driven experimental cholangitis by upregulating PD-L1 expression. J Hepatol 2021;74:919-30.
Creutzfeldt AM, Piecha F, Schattenberg JM, Schramm, Lohse AW. Long-term outcome in PSC patients receiving azathioprine: Does immunosuppression have a positive effect on survival. J Hepatol 2020;73:1285-87.
Gut mycobiome of primary sclerosing cholangitis patients is characterised by an increase of Trichocladium griseum and Candida species. Rühlemann MC, Solovjeva MEL, Zenouzi R, Liwinski T, Kummen M, Lieb W, Hov JR, Schramm C, Franke A, Bang C. Gut 2020;69:1890-92.
Kunzmann LK, Schoknecht T, Poch T, Henze L, Stein S, Kriz M, Grewe I, Preti M, Hartl J, Pannicke N, Peiseler M, Sebode M, Zenouzi R, Horvatits T, Böttcher M, Petersen BS, Weiler-Normann C, Hess LU, Elise Ahrenstorf A, Lunemann S, Martrus G, Fischer L, Li J, Carambia A, Kluwe J, Huber S, Lohse AW, Franke A, Herkel J, Schramm C, Schwinge D.Monocytes as potential mediators of pathogen-induced Th17 differentiation in patients with primary sclerosing cholangitis (PSC). Hepatology 2020;72:1310-26.
Henze L, Schwinge D and Schramm C. The Effects of Androgens on T Cells: Clues to Female Predominance in Autoimmune Liver Diseases? Front Immunol 2020;11:1567.
Sebode M, Reike-Kunze M, Weidemann S, Zenouzi R, Hartl J, Peiseler M, Liwinski T, Schulz L, Weiler-Normann C, Sterneck M, Lohse AW, Schramm C. Metamizole: An underrated agent causing severe idiosyncratic drug-induced liver injury. Br J Clin Pharmacol 2020;86:1406-15.
Goeppert B, Folseraas T, Roessler S, Kloor M, Volckmar AL, Endris V, Buchhalter I, Stenzinger A, Grzyb K, Grimsrud MM, Gornicka B, von Seth E, Reynolds GM, Franke A, Gotthardt DN, Mehrabi A, Cheung A, Verheij J, Arola J, Mäkisalo H, Eide TJ, Weidemann S, Cheville JC, Mazza G, Hirschfield GM, Ponsioen CY, Bergquist A, Milkiewicz P, Lazaridis KN, Schramm C, Manns MP, Färkkilä M, Vogel A; International PSC study group, Boberg KM, Schirmacher P, Karlsen TH. Genomic characterization of cholangiocarcinoma in primary sclerosing cholangitis reveals novel therapeutic opportunities. Hepatology 2020;72:1253-66.
Liwinski T, Zenouzi R, John C, Ehlken H, Rühlemann MC, Bang C, Groth S, Schachschal G, Lieb W, Kantowsk M, Rösch T, Andersen N, Karlsen TH, Hov JR, Lohse AW, Heeren J, Franke A, Schramm C. Alterations of the bile microbiome in primary sclerosing cholangitis. Gut 2020;69:665-72.
Liwinski T, Casar C, Ruehlemann MC, Bang C, Sebode M, Hohenester S, Denk G, Lieb W, Lohse AW, Franke A, Schramm C. A disease-specific decline of the relative abundance of Bifidobacterium in patients with autoimmune hepatitis. Aliment Pharmacol Ther 2020;51:1417-28.
Langeneckert AE, Lunemann S, Martrus G, Salzberger W, Hess LU, Ziegler AE, Poch T, Ravichandran G, Matschl U, Bosse JB, Tiegs G, Fischer L, Koch M, Herkel J, Oldhafer KJ, Schramm C, Altfeld M. CCL21-expression and accumulation of CCR7+ NK cells in livers of patients with primary sclerosing cholangitis. Eur J Immunol 2019;49:758-69.
Rühlemann M, Liwinski T, Heinsen FA, Bang C, Zenouzi R, Kummen M, Thingholm L, Tempel M, Lieb W, Karlsen T, Lohse AW, Hov J, Denk G, Lammert F, Krawczyk M, Schramm C, Franke A. Consistent Alterations in Fecal Microbiomes of Patients with Primary Sclerosing Cholangitis Independent of Associated Colitis. APT 2019;50:580-89.
Glaser F, John C, Engel B, Höh B, Weidemann S, Dieckhoff J, Stein S, Becker N, Casar C, Amrei Schuran F, Wieschendorf B, Preti M, Jessen F, Franke A, Carambia A, Lohse AW, Ittrich H, Herkel J, Heeren J, Schramm C, Schwinge D. Liver infiltrating T cells regulate bile acid metabolism in experimental cholangitis. J Hepatol 2019;71:783-92.
van Heesch S, Witte F, Schneider-Lunitz V, Schulz JF, Adami E, Faber AB, Kirchner M, Maatz H, Blachut S, Sandmann CL, Kanda M, Worth CL, Schafer S, Calviello L, Merriott R, Patone G, Hummel O, Wyler E, Obermayer B, Mücke MB, Lindberg EL, Trnka F, Memczak S, Schilling M, Felkin LE, Barton PJR, Quaife NM, Vanezis K, Diecke S, Mukai M, Mah N, Oh SJ, Kurtz A, Schramm C, Schwinge D, Sebode M, Harakalova M, Asselbergs FW, Vink A, de Weger RA, Viswanathan S, Widjaja AA, Gärtner-Rommel A, Milting H, Dos Remedios C, Knosalla C, Mertins P, Landthaler M, Vingron M, Linke WA, Seidman JG, Seidman CE, Rajewsky N, Ohler U, Cook SA, Hubner N. The Translational Landscape of the Human Heart. Cell 2019;178:242-260.e29.
Keller S, Sedlacik J, Schuler T, Buchert R, Avanesov M, Zenouzi R, Lohse AW, Kooijman H, Fiehler J, Schramm C, Yamamura J. Prospective comparison of diffusion-weighted MRI and dynamic Gd-EOB-DTPA-enhanced MRI for detection and staging of hepatic fibrosis in primary sclerosing cholangitis. Eur Radiol 2019;29:818-28.
Liwinski T, Schramm C. Primary sclerosing cholangitis: Current diagnostics and treatment. Internist (Berl) 2018;59:551-59.
Schramm C. Bile Acids, the Microbiome, Immunity, and Liver Tumors. N Engl J Med 2018;379:888-90.
Sebode M, Weiler-Normann C, Liwinski T, Schramm C. Autoantibodies in Autoimmune Liver Disease-Clinical and Diagnostic Relevance. Front Immunol 2018;9:609.
Schramm C, Eaton J, Ringe KI, Venkatesh S, Yamamura J; MRI working group of the IPSCSG.Recommendations on the use of MRI in PSC-A position statement from the International PSC study group. Hepatology 2017;66:1675-88.
Fickert P, Hirschfield GM, Denk G, Marschall HU, Altorjay I, Färkkilä M, Schramm C, Spengler U, Chapman R, Bergquist A, Schrumpf E, Nevens F, Trivedi P, Reiter FP, Tornai I, Halilbasic E, Greinwald R, Pröls M, Manns MP, Trauner M, European PSC norUDCA Study Group. norUrsodeoxycholic Acid Improves Cholestasis in Primary Sclerosing Cholangitis. J Hepatol 2017;67:549-58.
Aabakken L, Karlsen TH, Albert J, Arvanitakis M, Chazouilleres O, Dumonceau JM, Färkkilä M, Fickert P, Hirschfield GM, Laghi A, Marzioni M, Fernandez M, Pereira SP, Pohl J, Poley JW, Ponsioen CY, Schramm C, Swahn F, Tringali A, Hassan C. Role of endoscopy in primary sclerosing cholangitis: European Society of Gastrointestinal Endoscopy (ESGE) and European Association for the Study of the Liver (EASL) Clinical Guideline. Endoscopy 2017;49:588-608.
Ehlken H, Zenouzi R, Schramm C. Risk of cholangiocarcinoma in patients with primary sclerosing cholangitis: diagnosis and surveillance. Curr Opin Gastroenterol 2017;33:78-84.
Schoknecht T, Schwinge D, Stein S, Weiler-Normann C, Sebode M, Mucha S, Otto B, Ellinghaus E, Stahl F, Franke A, Lohse AW, Herkel J, Schramm C. CD4+ T cells from patients with primary sclerosing cholangitis exhibit reduced apoptosis and down-regulation of proapoptotic Bim in peripheral blood. J Leukoc Biol 2017;101:589-97.
Schwinge D, von Haxthausen F, Quaas A, Carambia A, Otto B, Glaser F, Höh B, Thiele N, Schoknecht T, Huber S, Steffens N, Lohse AW, Herkel J, Schramm C. Dysfunction of hepatic regulatory T cells in experimental sclerosing cholangitis is related with IL-12 signaling. J Hepatol 2017;66:798-805.
Ji SG, Juran BD, Mucha S, Folseraas T, Jostins L, Melum E, Kumasaka N, Atkinson EJ, Schlicht EM, Liu JZ, Shah T, Gutierrez-Achury J, Boberg KM, Bergquist A, Vermeire S, Eksteen B, Durie PR, Farkkila M, Müller T, Schramm C, Sterneck M, Weismüller TJ, Gotthardt DN, Ellinghaus D, Braun F, Teufel A, Laudes M, Lieb W, Jacobs G, Beuers U, Weersma RK, Wijmenga C, Marschall HU, Milkiewicz P, Pares A, Kontula K, Chazouillères O, Invernizzi P, Goode E, Spiess K, Moore C, Sambrook J, Ouwehand WH, Roberts DJ, Danesh J, Floreani A, Gulamhusein AF, Eaton JE, Schreiber S, Coltescu C, Bowlus CL, Luketic VA, Odin JA, Chopra KB, Kowdley KV, Chalasani N, Manns MP, Srivastava B, Mells G, Sandford RN, Alexander G, Gaffney DJ, Chapman RW, Hirschfield GM, de Andrade M; UK-PSC Consortium; International IBD Genetics Consortium; International PSC Study Group, Rushbrook SM, Franke A, Karlsen TH, Lazaridis KN, Anderson CA. Genome-wide association study of primary sclerosing cholangitis identifies new risk loci and quantifies the genetic relationship with inflammatory bowel disease. Nat Genet 2017;49:269-73.
Wang J, Thingholm LB, Skiecevičienė J, Rausch P, Kummen M, Hov JR, Degenhardt F, Heinsen FA, Rühlemann MC, Szymczak S, Holm K, Esko T, Sun J, Pricop-Jeckstadt M, Al-Dury S, Bohov P, Bethune J, Sommer F, Ellinghaus D, Berge RK, Hübenthal M, Koch M, Schwarz K, Rimbach G, Hübbe P, Pan WH, Sheibani-Tezerji R, Häsler R, Rosenstiel P, D'Amato M, Cloppenborg-Schmidt K, Künzel S, Laudes M, Marschall HU, Lieb W, Nöthlings U, Karlsen TH, Baines JF, Franke A.. Genome-wide association analysis identifies variation in vitamin D receptor and other host factors influencing the gut microbiota. Nat Genet 2016;48:1396-1406.
Ehlken H, Wroblewski R, Corpechot C, Arrivé L, Rieger T, Hartl J, Lezius S, Hübener P, Schulze K, Zenouzi R, Sebode M, Peiseler M, Denzer UW, Quaas A, Weiler-Normann C, Lohse AW, Chazouilleres O, Schramm C. Validation of Transient Elastography and Comparison with Spleen Length Measurement for Staging of Fibrosis and Clinical Prognosis in Primary Sclerosing Cholangitis. PLoS One 2016;11:e0164224.
Zenouzi R, Weismüller TJ, Jørgensen KK, Bubenheim M, Lenzen H, Hübener P, Schulze K, Weiler-Normann C, Sebode M, Ehlken H, Pannicke N, Hartl J, Peiseler M, Hübener S, Karlsen TH, Boberg KM, Manns MP, Lohse AW, Schramm C. No Evidence That Azathioprine Increases Risk of Cholangiocarcinoma in Patients With Primary Sclerosing Cholangitis. Clin Gastroenterol Hepatol 2016;14:1806-12.
Rühlemann MC, Heinsen FA, Zenouzi R, Lieb W, Franke A, Schramm C. Faecal microbiota profiles as diagnostic biomarkers in primary sclerosing cholangitis. Gut 2016;66:753-54.
Ellinghaus D, Jostins L, Spain SL, Cortes A, Bethune J, Han B, Park YR, Raychaudhuri S, Pouget JG, Hübenthal M, Folseraas T, Wang Y, Esko T, Metspalu A, Westra HJ, Franke L, Pers TH, Weersma RK, Collij V, D'Amato M, Halfvarson J, Jensen AB, Lieb W, Degenhardt F, Forstner AJ, Hofmann A; International IBD Genetics Consortium (IIBDGC); International Genetics of Ankylosing Spondylitis Consortium (IGAS); International PSC Study Group (IPSCSG); Genetic Analysis of Psoriasis Consortium (GAPC); Psoriasis Association Genetics Extension (PAGE), Schreiber S, Mrowietz U, Juran BD, Lazaridis KN, Brunak S, Dale AM, Trembath RC, Weidinger S, Weichenthal M, Ellinghaus E, Elder JT, Barker JN, Andreassen OA, McGovern DP, Karlsen TH, Barrett JC, Parkes M, Brown MA, Franke A. Analysis of five chronic inflammatory diseases identifies 27 new associations and highlights disease-specific patterns at shared loci. Nat Genet 2016;48:510-8.
Wang J, Kalyan S, Steck N, Turner LM, Harr B, Künzel S, Vallier M, Häsler R, Franke A, Oberg HH, Ibrahim SM, Grassl GA, Kabelitz D, Baines JF. Analysis of intestinal microbiota in hybrid house mice reveals evolutionary divergence in a vertebrate hologenome. Nat Commun 2015;4;6:6440.
Katt J, Schwinge D, Schoknecht T, Quaas A, Sobottka I, Burandt E, Becker C, Neurath MF, Lohse AW, Herkel J, Schramm C. Increased T helper type 17 response to pathogen stimulation in patients with primary sclerosing cholangitis. Hepatology 2013;58:1084-93.
-
Projekt 2: Analyse des pathogenetischen Zusammenhangs von chronisch entzündlichen Darmerkrankungen mit einer Primär Sklerosierenden Cholangitis
Projekt 2
Analyse des pathogenetischen Zusammenhangs von chronisch-entzündlichen Darmerkrankungen mit einer Primär Sklerosierenden Cholangitis
PSC Patienten in nordeuropäischen Ländern entwickeln mit einer Prävalenz von 60% - 80% ebenfalls eine chronisch-entzündliche Darmerkrankung (CED), insbesondere eine Colitis Ulcerosa (UC) ähnliche Erkrankung, und weisen darüber hinaus ein erhöhtes Risiko für die Entwicklung von Darmkrebs auf. Die Ursachen für diese Assoziation sind derzeit unzureichend verstanden.
Es gibt mehrere Hypothesen, die den Zusammenhang einer CED und PSC erklären könnten. Erstens könnten beiden Erkrankungen gemeinsame genetische Prädispositionen zugrunde liegen. Zweitens könnte eine CED die Entwicklung einer PSC begünstigen. Drittens könnte eine PSC die Entwicklung einer CED begünstigen. Das Ziel dieses Projekts ist es diese Hypothesen zu testen, wobei wir entgegen der Standardmeinung die dritte Hypothese favorisieren.
Des Weiteren glauben wir, dass ein Schlüssel zum besseren Verständnis der Assoziation von CED und PSC die Charakterisierung von Interaktionen des intestinalen Mikrobioms mit dem Gallensäuremetabolismus und der daraus resultierenden Aktivierung des intestinalen Immunsystems ist. Wir stellen die Hypothese auf, dass Interaktionen zwischen Gallensäuren in PSC-Patienten und ihrem intestinalen Mikrobiom die Suszeptibilität für die Entwicklung chronisch entzündlicher Darmerkrankungen und kolorektaler Karzinome fördern.
Projektleitung
 Prof. Dr. med.Samuel Huber
Prof. Dr. med.Samuel Huber- Klinikdirektor
- Leiter der molekularen Gastroenterologie und Immunologie
- Zentrum für Innere Medizin
- I. Medizinische Klinik und Poliklinik (Gastroenterologie mit Sektionen Infektiologie und Tropenmedizin)
- Facharzt für Innere Medizin und Gastroenterologie
Standort
Hauptgebäude O10 , 2. Etage Dr. rer. nat.Penelope Pelczar
Dr. rer. nat.Penelope Pelczar- Postdoc
Standort
Campus Forschung I - N27 , 4. Etage, Raumnummer 04.034Wissenschaftliche Mitarbeiter
 Friederike StummeM. Sc.
Friederike StummeM. Sc.- Naturwissenschaftliche Doktorandin
Standort
Campus Forschung I - N27 , 4. Etage, Raumnummer 04.034Aktuelle projektbezogene Publikationen
Poch T, Krause J, Casar C, Liwinski T, Glau L, Kaufmann M, Ahrenstorf AE, Hess LU, Ziegler AE, Martrus G, Lunemann S, Sebode M, Li J, Schwinge D, Krebs CF, Franke A, Friese MA, Oldhafer KJ, Fischer L, Altfeld M, Lohse AW, Huber S, Tolosa E, Gagliani N, Schramm C. Single-cell atlas of hepatic T cells reveals expansion of liver-resident naive-like CD4+ T cells in primary sclerosing cholangitis. J Hepatol 2021;S0168-8278(21)00219-1.
Kunzmann LK, Schoknecht T, Poch T, Henze L, Stein S, Kriz M, Grewe I, Preti M, Hartl J, Pannicke N, Peiseler M, Sebode M, Zenouzi R, Horvatits T, Böttcher M, Petersen BS, Weiler-Normann C, Hess LU, Elise Ahrenstorf A, Lunemann S, Martrus G, Fischer L, Li J, Carambia A, Kluwe J, Huber S, Lohse AW, Franke A, Herkel J, Schramm C, Schwinge D. Monocytes as potential mediators of pathogen-induced Th17 differentiation in patients with primary sclerosing cholangitis (PSC). Hepatology 2020;72:1310-26.
Ravichandran G, Neumann K, Berkhout LK, Weidemann S, Langeneckert AE, Schwinge D, Poch T, Huber S, Schiller B, Hess LU, Ziegler AE, Oldhafer KJ, Barikbin R, Schramm C, Altfeld M, Tiegs G. Interferon-γ-dependent immune responses contribute to the pathogenesis of sclerosing cholangitis in mice. J Hepatol. 2019;71:773-82.
Mathies F, Steffens N, Kleinschmidt D, Stuhlmann F, Huber FJ, Roy U, Meyer T, Luetgehetmann M, von Petersdorff M, Seiz O, Herkel J, Schramm C, Flavell RA, Gagliani N, Krebs C, Panzer U, Abdullah Z, Strowig T, Bedke T, Huber S. Colitis Promotes a Pathological Condition of the Liver in the Absence of Foxp3+ Regulatory T Cells. J Immunol 2018;201:3558-68.
Gagliani N, Vesely MC, Iseppon A, Brockmann L, Xu H, Palm NW, de Zoete MR, Licona-Limon P, Paiva RS, Ching T, Weaver C, Zi X, Pan X, Fan R, Garmire LX, Cotton MJ, Drier Y, Bernstein B, Geginat J, Stockinger B, Esplugues E, Huber S*, Flavell RA*. TH17 cells transdifferentiate into regulatory T cells during resolution of inflammation. Nature 2015;;523(7559):221-5.
Carambia A, Freund B, Schwinge D, Bruns OT, Salmen SC, Ittrich H, Reimer R, Heine M, Huber S, Waurisch C, Eychmuller A, Wraith DC, Korn T, Nielsen P, Weller H, Schramm C, Luth S, Lohse AW, Heeren J, Herkel J. Nanoparticle-based autoantigen delivery to Treg-inducing liver sinusoidal endothelial cells enables control of autoimmunity in mice. J Hepatol 2015;62:1349-56.
Bedke T*, Iannitti RG*, De Luca A, Giovannini G, Fallarino F, Berges C, Latge JP, Einsele H, Romani L, Topp MS. Distinct and complementary roles for Aspergillus fumigatus-specific Tr1 and Foxp3+ regulatory T cells in humans and mice. Immunol Cell Biol 2014;92:659-670.
Carambia A, Freund B, Schwinge D, Heine M, Laschtowitz A, Huber S, Wraith DC, Korn T, Schramm C, Lohse AW, Heeren J, Herkel J. TGF-beta-dependent induction of CD4(+)CD25(+)Foxp3(+) Tregs by liver sinusoidal endothelial cells. J Hepatol 2014;61:594-599.
*equally contributing authors
-
Projekt 3: Bedeutung des Lipidstoffwechsels für die Pathogenese der Primär Sklerosierenden Cholangitis (PSC)
Projekt 3
Bedeutung des Lipidstoffwechsels für die Pathogenese der Primär Sklerosierenden Cholangitis (PSC)
Bei PSC-Patienten ist der Stoffwechsel von lipophilen Metaboliten insbesondere in der Leber und im Intestinaltrakt vermutlich aufgrund des gestörten Gallentransportes verändert, wobei die Relevanz dieser komplexen Änderungen für die Pathogenese der PSC-Erkrankung nicht verstanden ist. Neben ihren vielfältigen Funktionen für die Homöostase des Stoffwechsels wurde in den letzten Jahren deutlich, dass Lipide entzündliche Prozesse sowie die Entstehung und Progression chronischer metabolischer Erkrankungen wie Nicht-alkoholische Steatohepatitis (NASH), Atherosklerose und Diabetes mellitus maßgeblich beeinflussen. Lipid-abhängige Signalwege werden über verschiedene Mechanismen überwiegend von Derivaten der Fettsäuren, Phospholipiden und Cholesterin gesteuert. Gallensäuren sind ebenfalls Derivate des Cholesterins und sind an der PSC-Pathogenese über verschiedene Mechanismen beteiligt. Unter physiologischen Bedingungen werden in der adulten, humanen Leber pro Tag ca. 500 mg Cholesterin zu Gallensäuren umgewandelt.
Die im Rahmen einer PSC-Erkrankung vorliegende Störung des Gallensäurenfluxes führt somit - vermutlich in Abhängigkeit vom gastrointestinalen Mikrobiom - zu komplexen Änderungen im systemischen und zellulären Lipoprotein-, Cholesterin- und Gallensäurestoffwechsel. Diese Wechselwirkung beeinflusst dabei vermutlich nicht nur metabolische, sondern auch immunologische Reaktionen und damit die Entstehung und Progression der PSC. Erste Studien zur Charakterisierung metabolischer Signaturen deuten auf differentielle Lipidmuster im Serum von Patienten mit PBC und PSC hin. Die gleichzeitige Analyse von potentiell immun-aktiven Cholesterin- und Gallensäurenderivaten aus Galle, Faeces, Leber, Urin und Lipoproteinfraktionen in diesen Patientenkollektiven, sowie die Analyse der funktionellen Bedeutung dieser Veränderungen u.a. durch Diät- und Interventionsstudien in relevanten Tiermodellen sind bislang nicht durchgeführt worden und sind Gegenstand dieses Teilprojektes.
Projektleitung
 Prof. Dr. rer. nat. Dipl.-Biochem.Jörg Heeren
Prof. Dr. rer. nat. Dipl.-Biochem.Jörg Heeren- Heisenberg-Professur für Immuno-Stoffwechsel
- Stellvertretender Institutsdirektor
Kontakt
Standort
N25 - Campus Forschung II, 2. Etage, Raumnummer 02.1.037Wissenschaftliche Mitarbeiter
Dr. rer. nat.Friederike Behler-JanbeckM. Sc.- Beschaffungsmanagerin
Standort
Quartier am Zeughaus, Christoph-Probst-Weg 2, 20251 Hamburg, 5. EtageAktuelle projektbezogene Publikationen
Pauly MJ, Rohde JK, John C, Evangelakos I, Koop AC, Pertzborn P, Tödter K, Scheja L, Heeren J, Worthmann A. Inulin Supplementation Disturbs Hepatic Cholesterol and Bile Acid Metabolism Independent from Housing Temperature. Nutrients. 2020;12:3200.
Glaser F, John C, Engel B, Höh B, Weidemann S, Dieckhoff J, Stein S, Becker N, Casar C, Schuran FA, Wieschendorf B, Preti M, Jessen F, Franke A, Carambia A, Lohse AW, Ittrich H, Herkel J, Heeren J, Schramm C, Schwinge D. Liver infiltrating T cells regulate bile acid metabolism in experimental cholangitis. J Hepatol 2019;71:783-92.
Liwinski T, Zenouzi R, John C, Ehlken H, Rühlemann MC, Bang C, Groth S, Lieb W, Kantowski M, Andersen N, Schachschal G, Karlsen TH, Hov JR, Rösch T, Lohse AW, Heeren J, Franke A, Schramm C. Alterations of the bile microbiome in primary sclerosing cholangitis. Gut 2020;69:665-72.
Berbée JF, Boon MR, Khedoe PP, Bartelt A, Schlein C, Worthmann A, Kooijman S, Hoeke G, Mol IM, John C, Jung C, Vazirpanah N, Brouwers LP, Gordts PL, Esko JD, Hiemstra PS, Havekes LM, Scheja L, Heeren J*, Rensen PC*. Brown fat activation reduces hypercholesterolaemia and protects from atherosclerosis development. Nat Commun 2015;6:6356.
Hoffmann LS, Etzrodt J, Willkomm L, Sanyal A, Scheja L, Fischer AW, Stasch JP, Bloch W, Friebe A, Heeren J, Pfeifer A. Stimulation of soluble guanylyl cyclase protects against obesity by recruiting brown adipose tissue. Nat Commun 2015;6:7235.
Baumeier C, Kaiser D, Heeren J, Scheja L, John C, Weise C, Eravci M, Lagerpusch M, Schulze G, Joost HG, Schwenk RW, Schürmann A. Caloric restriction and intermittent fasting alter hepatic lipid droplet proteome and diacylglycerol species and prevent diabetes in NZO mice. Biochim Biophys Acta 2015;1851:566-76.
-
Projekt 4: Die Rolle von IFN-gamma in der Immunpathogenese der PSC
Projekt 4
Die Rolle von IFN-gamma in der Immunpathogenese der PSC
Die Expression verschiedener IFNγ-assozierter Cytokine und Chemokine ist bei PSC Patienten erhöht, ihre Rolle für die Pathogenese ist jedoch unklar. PSC Patienten zeigen sowohl erhöhte IFN-γ Werte im Serum, als auch vermehrt IFN-γ positive Lymphozyten im Lebergewebe.
Neutralisation von IFNγ reduziert Fibrose sowie NK- und CD8+ T-Zell-Antwort in Mdr2-/- Mäusen. Mdr2-/- Mäuse wurden mit Kontroll-IgG oder anti-IFNg Antikörper für 2 Wochen (2x pro Woche 0.5mg/Maus) behandelt. Der Grad der Fibrose wurde nach dem Scheuer System von einem Pathologen bestimmt (A). Nicht-parenchymale Zellen der Leber wurden mit PMA [50ng/ml] und Ionomycin [1µg/ml] stimuliert, mit Brefeldin A [10µg/ml] behandelt, für 6 Stunden inkubiert und durchflusszytometrisch analysiert (B,C).
Unsere Arbeitshypothese ist, dass IFNγ-produzierende Immunzellen eine wesentliche Rolle in der Pathogenese der PSC spielen und dass die Neutralisierung von IFNg oder Depletion der IFNg-produzierenden Lymphozyten eine Verbesserung des Krankheitsbildes zur Folge hat. Wir werden deshalb folgende Ziele verfolgen:
- Zur Charakterisierung der Immunantwort werden Frequenz, Phänotyp, Funktion und Aktivierungsgrad von Lymphozytenpopulationen peripherer mononukleärer Blutzellen (PBMCs) aus PSC Patienten bestimmt. Auf diesem Wege sollen die Zellen identifiziert werden, die IFNγ-produzieren oder aber durch IFNγ aktiviert werden. Die identifizierten Zellpopulationen sollen darauffolgend in leberinfiltrierenden Lymphozyten aus Explantat-Lebern von PSC Patienten bestätigt werden. Wir gehen davon aus, dass der von den Immunzellen verursachte Schaden auf deren Zytotoxizität zurückzuführen ist.
- Funktionelle Analysen sollen in vivo in unterschiedlichen Mausmodellen durchgeführt werden. In einem therapeutischen Ansatz sollen die Immunzellpopulationen, die IFNγ produzieren, bzw. durch IFNγ aktiviert werden, durch die Applikation von Antikörpern depletiert und die Effekte auf die Pathogenese der Cholangitis untersucht werden.
- Durch Charakterisierung der IFNγ-vermittelten Signaltransduktion wird es möglich abzuschätzen, ob beispielsweise bereits zugelassene MAPK Inhibitoren für die Therapie der PSC in Frage kämen.
- Zur weiteren Analyse der Funktion der Immunzellen und ihrer Lokalisation sollen Mausmodelle etabliert werden, die eine chronische Cholangitis aufweisen und gleichzeitig defizient für IFNg bzw. die entsprechenden IFNg-produzierenden Zellen sind.
Projektleitung
Aktuelle projektbezogene Publikationen
Horst AK, Kumashie KG, Neumann K, Diehl L, Tiegs G. Antigen presentation, autoantibody production, and therapeutic targets in autoimmune liver disease. Cell Mol Immunol. 2021;18:92-111.
Hess LU, Martrus G, Ziegler AE, Langeneckert AE, Salzberger W, Goebels H, Sagebiel AF, Hagen SH, Poch T, Ravichandran G, Koch M, Schramm C, Oldhafer KJ, Fischer L, Tiegs G, Richert L, Bunders MJ, Lunemann S, Altfeld M. The Transcription Factor Promyelocytic Leukemia Zinc Finger Protein Is Associated With Expression of Liver-Homing Receptors on Human Blood CD56bright Natural Killer Cells. Hepatol Commun. 2020;4:409-24.
Ravichandran G, Neumann K, Berkhout LK, Weidemann S, Langeneckert AE, Schwinge D, Poch T, Huber S, Schiller B, Hess LU, Ziegler AE, Oldhafer KJ, Barikbin R, Schramm C, Altfeld M, Tiegs G. Interferon-γ-dependent immune responses contribute to the pathogenesis of sclerosing cholangitis in mice. J Hepatol 2019;71:773-82.
Schwinge D, Carambia A, Quaas A, Krech T, Wegscheid C, Tiegs G, Prinz I, Lohse AW, Herkel J, Schramm C. Testosterone suppresses hepatic inflammation by the downregulation of IL-17, CXCL-9, and CXCL-10 in a mouse model of experimental acute cholangitis. J Immunol 2015;194:2522-30.
Burghardt S, Claass B, Erhardt A, Karimi K, Tiegs G. Hepatocytes induce Foxp3+ regulatory T cells by Notch signaling. J Leukoc Biol 2014;96:571-77.
Burghardt S, Erhardt A, Claass B, Huber S, Adler G, Jacobs T, Chalaris A, Schmidt-Arras D, Rose-John S, Karimi K, Tiegs G. Hepatocytes contribute to immune regulation in the liver by activation of the Notch signaling pathway in T cells. J Immunol 2013;191:5574-82.
Barikbin R, Neureiter D, Wirth J, Erhardt A, Schwinge D, Kluwe J, Schramm C, Tiegs G, Sass G. Induction of heme oxygenase 1 prevents progression of liver fibrosis in Mdr2 knockout mice. Hepatology 2012;55:553-62.
-
Projekt 5: Rolle dendritischer Zellen in der Pathogenese der PSC
Projekt 5
Die Rolle dendritischer Zellen in der Pathogenese der PSC
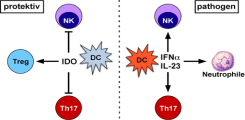
In diesem Projekt soll die Hypothese untersucht werden, dass dendritische Zellen (DCs) in der PSC Pathogenese eine wichtige Rolle spielen. Wir vermuten eine entscheidende krankheitsmodulierende Funktion durch Leber-DCs, da diese, aufgrund ihrer Positionierung in den Portalfeldern um die Gallengänge herum, eine wichtige Wächterfunktion übernehmen und Entzündungsreaktionen einleiten können.
Insbesondere in der frühen Entzündungsphase der PSC scheinen DCs eine wichtige Rolle zu spielen und auf mikrobielle Stimuli zu. Dabei kann sowohl eine erhöhte mikrobielle Translokation aus dem Darm über das Pfortaderblut, aber auch eine aberrante Keimbesiedlung der Gallengänge zu einer Aktivierung der Leber-DCs führen. Je nach Kontext können DCs dann Entzündung fördern oder hemmen, indem sie andere Zelltypen entsprechend beeinflussen, wobei verschiedene DC Subpopulationen unterschiedliche Funktionen ausüben.
Projektleitung
 Prof. Dr. rer. nat.Johannes Herkel
Prof. Dr. rer. nat.Johannes Herkel- Forschungsgruppenleiter
Standort
O58, 3. Etage, Raumnummer 306 Prof. Dr.Marcus Altfeld
Prof. Dr.Marcus Altfeld- Projektleiter
Kontakt
TelefonTelefaxStandort
HPI, 1. Etage, Raumnummer N63 | 1105Wissenschaftliches Personal
AG Herkel
Aktuelle projektbezogene Publikationen
Poch T, Krause J, Casar C, Liwinski T, Glau L, Kaufmann M, Ahrenstorf AE, Hess LU, Ziegler AE, Martrus G, Lunemann S, Sebode M, Li J, Schwinge D, Krebs CF, Franke A, Friese MA, Oldhafer KJ, Fischer L, Altfeld M, Lohse AW, Huber S, Tolosa E, Gagliani N, Schramm C. Single-cell atlas of hepatic T cells reveals expansion of liver-resident naive-like CD4+ T cells in primary sclerosing cholangitis. J Hepatol 2021;S0168-8278(21)00219-1.
Preti M, Schlott L, Lübbering D, Krzikalla D, Müller AL, Schuran FA, Poch T, Schakat M, Weidemann S, Lohse AW, Weiler-Normann C, Sebode M, Schwinge D, Schramm C, Carambia A, Herkel J. Failure of thymic deletion and instability of autoreactive Tregs drive autoimmunity in immune-privileged liver. JCI Insight 2021;6:e141462.
Hess LU, Martrus G, Ziegler AE, Langeneckert AE, Salzberger W, Goebels H, Sagebiel AF, Hagen SH, Poch T, Ravichandran G, Koch M, Schramm C, Oldhafer KJ, Fischer L, Tiegs G, Richert L, Bunders MJ, Lunemann S, Altfeld M. The Transcription Factor Promyelocytic Leukemia Zinc Finger Protein Is Associated With Expression of Liver-Homing Receptors on Human Blood CD56 bright Natural Killer Cells. Hepatol Commun 2020;4(3):409-24.
Kunzmann LK, Schoknecht T, Poch T, Kauer L, Stein S, Kriz M, Grewe I, Preti M, Hartl J, Pannicke N, Peiseler M, Sebode M, Zenouzi R, Petersen BS, Weiler-Normann C, Hess L, Langeneckert A, Lunemann S, Martrus G, Fischer L, Li J, Carambia A, Lohse AW, Franke A, Herkel J, Schramm C, Schwinge D. Monocytes as mediators of pathogen-induced Th17 differentiation in patients with primary sclerosing cholangitis (PSC). Hepatology 2020. doi: 10.1002/hep.31140. [Epub ahead of print]
Martrus G, Goebels H, Langeneckert AE, Kah J, Flomm F, Ziegler AE, Niehrs A, Löbl SM, Russu K, Hess LU, Salzberger W, Poch T, Nashan B, Schramm C, Oldhafer KJ, Dandri M, Koch M, Lunemann S, Altfeld M. CD49a Expression Identifies a Subset of Intrahepatic Macrophages in Humans. Front Immunol 2019;10:1247.
Bovensiepen CS*, Schakat M*, Sebode M, Zenouzi R, Hartl J, Peiseler M, Li J, Schramm C, Lohse AW, Herkel J, Weiler-Normann C. TNF-producing Th1 cells are selectively expanded in liver infiltrates of patients with autoimmune hepatitis. J Immunol 2019;203:3148-56.
Glaser F, John C, Engel B, Höh B, Weidemann S, Dieckhoff J, Stein S, Becker N, Casar C, Schuran FA, Wieschendorf B, Preti M, Jessen F, Franke A, Carambia A, Lohse AW, Ittrich H, Herkel J, Heeren J, Schramm C, Schwinge D. Liver infiltrating T cells regulate bile acid metabolism in experimental cholangitis. J Hepatol 2019;71:783-92.
Langeneckert AE, Lunemann S, Martrus G, Salzberger W, Hess LU, Ziegler AE, Poch T, Ravichandran G, Matschl U, Bosse JB, Tiegs G, Fischer L, Koch M, Herkel J, Oldhafer KJ, Schramm C, Altfeld M. CCL21-expression and accumulation of CCR7+ NK cells in livers of patients with primary sclerosing cholangitis. Eur J Immunol 2019;49:758-69.
Mathies F, Steffens N, Kleinschmidt D, Stuhlmann F, Huber FJ, Roy U, Meyer T, Luetgehetmann M, von Petersdorff M, Seiz O, Herkel J, Schramm C, Flavell RA, Gagliani N, Krebs C, Panzer U, Abdullah Z, Strowig T, Bedke T, Huber S. Colitis Promotes a Pathological Condition of the Liver in the Absence of Foxp3+ Regulatory T Cells. J Immunol 2018;201:3558-68.
Carambia A, Herkel J. Dietary and metabolic modulators of hepatic immunity. Semin Immunopathol 2018;40:175-88.
Schwinge D, von Haxthausen F, Quaas A, Carambia A, Otto B, Glaser F, Höh B, Thiele N, Schoknecht T, Huber S, Steffens N, Lohse AW, Herkel J, Schramm C. Dysfunction of hepatic regulatory T cells in experimental sclerosing cholangitis is related to IL-12 signaling. J Hepatol 2017;66:798-805.
Schoknecht T, Schwinge D, Stein S, Weiler-Normann C, Sebode M, Mucha S, Otto B, Ellinghaus E, Stahl F, Franke A, Lohse AW, Herkel J, Schramm C. CD4+ T cells from patients with primary sclerosing cholangitis exhibit reduced apoptosis and down-regulation of proapoptotic Bim in peripheral blood. J Leukoc Biol 2017;101:589-97.
Altfeld M, Gale M. Innate Immunity against HIV-1 infection. Nat Immunol 2015;16:554-62.
-
Projekt 6: Die Rolle von NETs und extrazellulärer DNA in der Pathogenese der PSC
Projekt 6
Die Rolle von NETs und extrazellulärer DNA in der Pathogenese der PSC
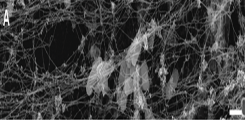
Neutrophil Extracellular Traps (NETs) bestehen aus DNA-Filamenten, die ein extrazelluläres, netzartiges Geflecht bilden. Neutrophile bilden NETs in Infektionen, um pathogene Bakterien einzufangen und abzutöten (Abb. 1).
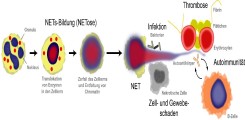
Die antimikrobielle Funktion von NETs basiert hierbei auf Histonen und Enzymen aus Granula, die an den extrazellulären DNA-Filamenten anheften. Die NET-Bildung (NETose) ist ein Prozess, in dem Kern-DNA dekondensiert wird und sich intrazelluläre Membranen auflösen (Abb. 2, links). Als Konsequenz vermischen sich DNA-Filamente und granuläre Proteine innerhalb der Zelle. Neutrophile sind anschließend in der Lage durch mehrere Mechanismen NETs aus der Zelle zu schleusen. Kontrolliert wird die NETose durch das Enzym Peptidylargininedeiminase 4 (PAD4). PAD4 ist eine von insgesamt 4 PADs im Menschen. PAD4 enthält ein Kernlokalisationssignal und wird selektiv in Neutrophilen exprimiert. In aktivierten Neutrophilen wandert PAD4 in den Zellkern, um Argininreste in Histonen zu Citrullin umzuwandeln. Als Konsequenz verringert sich die positive Ladung von Histonen, die Bindung von Histonen zu DNA wird geschwächt und die DNA entfaltet sich.
Die antimikrobielle Aktivität von NETs wurde zusammen mit deren Entdeckung vor ca. 10 Jahren beschrieben. In den letzten Jahren häufen sich die Anzeichen, dass NETs integraler Bestandteil der Pathogenese von entzündlichen Erkrankungen sind. Grund hierfür sind prothrombotische, zytotoxische und immunogene Eigenschaften von NETs, die vor allem durch Histone und Neutrophilen-Enzyme in NETs vermittelt werden (Abb. 2, rechts). Histone bilden mit 70% den Hauptanteil der Proteine in NETs. Sie verfügen neben ihrer Funktion in der Verpackung von DNA über bemerkenswerte zytotoxische Eigenschaften.
NETs können somit über die Bildung von Immunkomplexen zur Krankheitsentstehung beitragen. NETs wurden in einer Reihe autoimmuner Erkrankungen nachgewiesen. So zeigten histologische Untersuchungen von Nierenbiopsien die für NETs charakteristischen Komplexe aus extrazellulärer DNA, Histonen und MPO in Patienten mit Anti-Neutrophilen-zytoplasmatischen-Antikörper-(ANCA)-assoziierten Vaskulitiden. ANCA sind mit primär sklerosierender Cholangitis (PSC) assoziiert. Ob NETs in PSC gebildet werden und welche Funktion sie in der Pathogenese einnehmen, ist nicht erforscht. Es gibt allerdings Hinweise für eine zentrale Rolle von Neutrophilen in der PSC: Antikörper gegen Neutrophile können in bis zu 38% der PSC-Patienten im Serum und der Gallenflüssigkeit nachgewiesen werden.
Projektleitung
 Prof. Dr. Dr.Thomas Renné
Prof. Dr. Dr.Thomas Renné- Institutsdirektor
- Facharzt für Laboratoriumsmedizin
Standort
O26 , 1. Etage, Raumnummer 195Wissenschaftlicher Mitarbeiter
Aktuelle projektbezogene Publikationen
Englert H, Rangaswamy C, Deppermann C, Sperhake JP, Krisp C, Schreier D, Gordon E, Konrath S, Haddad M, Pula G, Mailer RK, Schlüter H, Kluge S, Langer F, Püschel K, Panousis K, Stavrou EX, Maas C, Renné T, Frye M. Defective NET clearance contributes to sustained FXII activation in COVID-19-associated pulmonary thrombo-inflammation. EBioMedicine 2021;67:103382.
Mailer RK, Allende M, Heestermans M, Schweizer M, Deppermann C, Frye M, Pula G, Odeberg J, Gelderblom M, Rose-John S, Sickmann A, Blankenberg S, Huber TB, Kubisch C, Maas C, Gambaryan S, Firsov D, Stavrou EX, Butler LM, Renné T. Xenotropic and polytropic retrovirus receptor 1 regulates procoagulant platelet polyphosphate. Blood 2021;137:1392-1405.
Henderson MW, Sparkenbaugh EM, Wang S, Ilich A, Noubouossie DF, Mailer RK, Renné T, Flick MJ, Luyendyk JP, Chen ZL, Strickland S, Stravitz RT, McCrae KR, Key NS, Pawlinski R. Plasmin-mediated Cleavage of High Molecular Weight Kininogen Contributes to Acetaminophen-Induced Acute Liver Failure. Blood 2021:blood.2020006198.
Rangaswamy C, Mailer RK, Englert H, Konrath S, Renné T. The contact system in liver injury. Semin Immunopathol 2021:1–11.
Rangaswamy C*, Englert H*, Deppermann C, Renné T. Polyanions in Coagulation and Thrombosis: Focus on Polyphosphate and Neutrophils Extracellular Traps. Thromb Haemost 2020.
Schmidt T, Schmidt C, Strahl A, Mussawy H, Rolvien T, Jandl NM, Casar C, Oheim R, Schinke T, Lohse AW, Amling M, Schramm C, Barvencik F. A System to Determine Risk of Osteoporosis in Patients with Autoimmune Hepatitis. Clin Gastroenterol Hepatol 2020;18:226-33.e3.
Panda R, Krieger T, Hopf L, Renné T, Haag F, Röber N, Condrad K, Csernok E, Fuchs TA. Neutrophil extracellular traps contain selected antigens of anti-neutrophil cytoplasmic antibodies. Frontiers in Immunology 2017;8:439.
Jiménez-Alcázar M, Napirei M, Panda R, Köhler EC, Kremer Hovinga JA, Mannherz HG, Peine S, Renné T, Lämmle B, Fuchs TA. Impaired DNase1-mediated degradation of neutrophil extracellular traps is associated with acute thrombotic microangiopathies. J Thromb Haemost 2015;5:732-42.
Hartl J, Ehlken H, Weiler-Normann C, Sebode M, Kreuels B, Pannicke N, Zenouzi R, Glaubke C, Lohse AW, Schramm C. Patient selection based on treatment duration and liver biochemistry increases success rates after treatment withdrawal in autoimmune hepatitis. J Hepatol 2015;62:642-6.
Lohse AW, Weiler-Normann C. Not all PBC is the same! Gastroenterology 2013;144:494-7.
Weiler-Normann C, Schramm C, Quaas A, Wiegard C, Glaubke C, Pannicke N, Möller S, Lohse AW. Infliximab as a rescue treatment in difficult-to-treat autoimmune hepatitis. J Hepatol 2013;58:529-34.
*equally contributing authors
-
Projekt 8: Einfluss der PSC auf das skelettale Remodeling
Projekt 8
Einfluss der PSC auf das skelettale Remodeling
Um eine Langzeitstabilität des Skeletts zu erreichen, unterliegt die Knochenmatrix einem ständigen Umbau, genannt Knochen-Remodeling. Dieser physiologisch relevante Prozess wird durch die koordinierte Aktivität zweier Zelltypen vermittelt, den Knochen-bildenden Osteoblasten und den Knochen-resorbierenden Osteoklasten. Eine Störung des zellulären Gleichgewichts zwischen diesen beiden Zelltypen bildet die Grundlage zahlreicher skelettaler Erkrankungen, wobei die Osteoporose die mit Abstand höchste Prävalenz aufweist.
Die Entwicklung einer Osteoporose gilt als prinzipielle Komplikation bei chronischen cholestatischen Lebererkrankungen, wobei sich die meisten publizierten Studien auf die primäre biliäre Zirrhose (PBC) beziehen. Obwohl die hier beschriebene Osteoporose-Prävalenz durchschnittlich im Bereich von 30 % lag, konnten die zugrundeliegenden Mechanismen jedoch noch nicht geklärt werden. Gleiches gilt für die PSC, die im Vergleich zur PBC eher in jüngeren Patienten auftritt, von denen mehr als 60 % chronisch entzündliche Darmerkrankungen (CED) im Sinne einer PSC-assoziierten Colitis aufweisen. Zwar konnte in einer umfassenden Studie durch jährliche Messung des Knochenmineralgehalts nachgewiesen werden, dass 15 % der insgesamt 273 untersuchten Patienten mit PSC eine Osteoporose entwickeln, allerdings wurden hierbei nicht alle Parameter des Knochen-Remodelings evaluiert.
Abb.: Osteologische Untersuchung eines 46-jährigen Patienten mit PSC.
(A) Die Ermittlung des Knochenmineralgehalts mittels DXA ergab einen T-Wert von – 2,6 und somit die Diagnose einer Osteoporose. Die rechts eingezeichneten Linien geben Mittelwert + Standardweichung in der Skelett-gesunden Bevölkerung an.
(B) Durch HR-pQCT Messung an der Tibia zeigte sich, dass nur die Trabekel-Anzahl (Tb.N, trabecular number) im Referenzbereich lag, während das trabekuläre Knochenvolumen (BV/TV, bone volume per tissue volume), die trabekuläre Knochendichte (Tb.Th. trabecular thickness) und die kortikale Dicke (C.Th., cortical thickness) deutlich reduziert waren.
Neben der inflammatorischen Komponente der PSC-assoziierten Osteoporose, deren Relevanz im vorliegenden Projekt untersucht werden soll, gibt es weitere Erklärungsansätze für den Einfluss einer PSC auf das Knochen-Remodeling. So konnte in vitro gezeigt werden, dass Bilirubin, dessen Serum-Konzentration im Verlauf der PSC ansteigt, einen negativen Einfluss auf die Proliferation humaner Osteoblasten vermittelt. Zudem wurde oftmals diskutiert, dass eine Störung der Vitamin-D-Synthese einen negativen Einfluss auf die Knochenmineralisation vermitteln könnte, was jedoch in einigen klinischen Studien zu chronisch cholestatischen Lebererkrankungen nicht bestätigt werden konnte.
Ziel dieses Projekts ist es, die vorhandene Infrastruktur am Institut für Osteologie und Biomechanik zu nutzen, um die bei PSC-Patienten auftretende Osteopathie auf zellulärer und molekularer Ebene zu verstehen. Hierbei ist es entscheidend, dass die klinische Relevanz der erzielten Daten nur in Kombination mit den Erkenntnissen aus anderen Teilprojekten der Forschergruppe validiert werden kann, da es von zentraler Bedeutung sein wird, den Knochen-Status mit anderen klinischen Parametern zu korrelieren. Unsere Hypothese ist, dass die mit PSC assoziierten skelettalen Pathologien primär auf einer Hemmung der kortikalen Knochenbildung beruhen, welche durch bestimmte Zytokine (z.B. IL17, IL22) vermittelt sein könnte. Zusätzlich zu unserem Hypothesen-orientierten Ansatz verfolgen wir allerdings auch eine ergebnisoffene Strategie, mit der auch weitere Erklärungsmöglichkeiten (z.B. ein Einfluss von Gallensäuren, eine Aktivierung der Osteoklasten oder eine Störung der Mineral-Homöostase) überprüft werden sollen. Vor dem Hintergrund, dass es bislang keine zellulären oder molekularen Erkenntnisse gibt, welche die hohe Prävalenz der Osteoporose bei PSC-Patienten erklären, ist es zudem wahrscheinlich, dass die Planung des Projekts im Verlauf noch Ergebnis-abhängig modifiziert wird.
Projektleitung
 Prof. Dr. med.Michael AmlingMBA
Prof. Dr. med.Michael AmlingMBA- Institutsdirektor
- Facharzt für Orthopädie und Unfallchirurgie
Standort
Lottestraße 59, 22529 Hamburg, 1. Etage Prof. Dr. rer. nat.Thorsten Schinke
Prof. Dr. rer. nat.Thorsten Schinke- Stellvertretender Institutsdirektor
Standort
Campus Forschung I - N27 , 1. EtageWissenschaftliche Mitarbeiter
 Dr. med.Julian Stürznickel
Dr. med.Julian Stürznickel- Assistenzarzt
Standort
Lottestraße 59, 22529 Hamburg, 1. EtageAktuelle projektbezogene Publikationen
Schmidt C, Stürznickel J, Strahl A, Oheim R, Weiler-Normann C, Sebode M, Barvencik F, Lohse AW, Schinke T, Amling M, Schramm C, Rolvien T. Bone microarchitecture in patients with autoimmune hepatitis. J Bone Miner Res 2021 doi: 10.1002/jbmr.4289. [Epub ahead of print]
Schmidt T, Schmidt C, Strahl A, Mussawy H, Rolvien T, Jandl NM, Casar C, Oheim R, Schinke T, Lohse AW, Amling M, Schramm C, Barvencik F. A System to Determine Risk of Osteoporosis in Patients With Autoimmune Hepatitis. Clin Gastroenterol Hepatol 2020;18:226-33.e3.
Schmidt T, Schwinge D, Rolvien T, Jeschke A, Schmidt C, Neven M, Butscheidt S, Kriz M, Kunzmann L, Mussawy H, Hubert J, Hawellek T, Rüther W, Oheim R, Barvencik F, Lohse AW, Schramm C, Schinke T, Amling M. Th17 cell frequency is associated with low bone mass in primary sclerosing cholangitis. J Hepatol 2019;70:941-53.
Schmidt T, Schmidt C, Schmidt FN, Butscheidt S, Mussawy H, Hubert J, Hawellek T, Oehler N, Barvencik F, Lohse AW, Schinke T, Schramm C, Amling M, Rolvien T. Disease Duration and Stage Influence Bone Microstructure in Patients With Primary Biliary Cholangitis. J Bone Miner Res 2018;33:1011-19.
Schmidt T, Schmidt C, Strahl A, Mussawy H, Rolvien T, Jandl NM, Casar C, Oheim R, Schinke T, Lohse AW, Amling M, Schramm C, Barvencik F. A System to Determine Risk of Osteoporosis in Patients With Autoimmune Hepatitis. Clin Gastroenterol Hepatol 2019;18:226-33.e3.
Schmidt T, Schwinge D, Rolvien T, Jeschke A, Schmidt C, Neven M, Butscheidt S, Kriz M, Kunzmann L, Mussawy H, Hubert J, Hawellek T, Rüther W, Oheim R, Barvencik F, Lohse AW, Schramm C, Schinke T, Amling M. Th17 cell frequency is associated with low bone mass in primary sclerosing cholangitis. J Hepatol 2019;70:941-53.
Schmidt T, Schmidt C, Schmidt FN, Butscheid S, Mussawy H, Hubert J,Hawellek T, Oehler N, Barvencik F, Lohse AW, Schinke T, Schramm C, Amling M, Rolvien T. Disease Duration and Stage Influence Bone Microstructure in Patients With Primary Biliary Cholangitis. J Bone Miner Res 2018;33:1011-19.
Jeschke A, Catala-Lehnen P, Sieber S, Bickert T, Schweizer M, Koehne T, Wintges K, Marshall RP, Mautner A, Duchstein L, Otto B, Horst AK, Amling M, Kreienkamp HJ, Schinke T. Sharpin Controls Osteogenic Differentiation of Mesenchymal Bone Marrow Cells. J Immunol 2015;195:3675-84.
Krause M, Keller J, Beil B, van Driel I, Zustin J, Barvencik F, Schinke T, Amling M. Calcium gluconate supplementation is effective to balance calcium homeostasis in patients with gastrectomy. Osteoporos Int 2015;26:987-95.
Keller T, Catala-Lehnen P, Huebner AK, Jeschke A, Lueth A, Krause M, Koehne T, Albers J, Schulze J, Schilling S, Haberland M, Denninger H, Heckt T, Neven M, Hermans-Borgmeyer I, Streichert T, Breer S, Barvencik F, Levkau B, Rathkolb B, Wolf E, Calzada-Wack J, Neff F, Gailus-Durner V, Fuchs H, Hrabe de Angelis M, Klutmann S, Tsourdi E, Hofbauer LC, Kleuser B, Chun J, Schinke T, Amling M. Calcitonin controls bone formation by inhibiting the release of sphingosine 1-phosphate from osteoclasts. Nat Comm 2014;5:5215.
Barvencik F, Kurth I, Koehne T, Stauber T, Zustin J, Tsiakas K, Ludwig CF, Beil FT, Pestka JM, Hahn M, Santer R, Supanchart C, Kornak U, Del Fattore A, Jentsch TJ, Teti A, Schulz A, Schinke T, Amling M. CLCN7 and TCIRG1 mutations differentially affect bone matrix mineralization in osteopetrotic individuals. J Bone Miner Res 2014;29:982-91.
Keller J, Schinke T. The role of the gastrointestinal tract in calcium homeostasis and bone remodeling. Osteoporos Int 2013;24:2737-48.
-
Projekt 10: Inflammationsprozesse von Cholangiokarzinomen bei PSC
Projekt 10
Inflammatorische Prozesse in der Entwicklung des Cholangiokarzinoms bei PSC - Welche Rolle spielen die T-Zellen?
Cholangiokarzinome (CCA) sind die gefürchtetste Komplikation bei Patienten mit primär sklerosierender Cholangitis (PSC). Bis zu 40 % der PSC Patienten entwickeln ein Cholangiokarzinom im Laufe ihrer Erkrankung. Die Prognose dieser Krebserkrankung ist sehr schlecht und die Pathogenese der Tumorentstehung bislang unverstanden.
Studien konnten bereits zeigen, dass PSC-assoziierte Cholangiokarzinome (PSC-CCA) mit chronisch-biliärer Entzündung mit biliärer Metaplasie und Dysplasie assoziiert sind, was ein typisches Bild bei der PSC ist. Darüberhinaus sind das Immunsystem und die Mikrobiota bei diesen Patienten verändert. Der Einfluss der Mikrobiota auf die T Zell Funktion wurde bereits in der Karzinogenese anderer Tumorerkrankungen impliziert. Basierend auf diesen Daten vermuten wir, dass die PSC-spezifische Mikrobiota die pro-kanzerogene Funktion der T Zellen begünstigt, was schließlich zur Tumorentstehung bei PSC Patienten führt.
Das Ziel unseres Projektes ist, den funktionellen Phänotypen der T Zellen in PSC-CCA mithilfe von Einzelzell-RNA/TCR Sequenzierung zu definieren. Die Ergebnisse erlauben uns, neue Zellpopulationen und deren Verhältnis zueinander, sowie dessen pro- oder anti-kanzerogenem funktionellen Phänotypen zu identifizieren. Zusätzlich können durch die Bestimmung des co-inhibitorischen Rezeptorprofils dieser Populationen zukünftig ad hoc Immuntherapien (wie z.B. anti-PD-1) für diese Patienten impliziert werden. Daneben ist ein weiteres Ziel, die krankheitsspezifische Mikrobiota sowohl des Intestinums als auch der Gallenwege zu identifizieren und deren Einfluss auf die Immunantwort der T Zellen zu verstehen.
Darüberhinaus arbeitet unsere Arbeitsgruppe an der Entwicklung eines neuen spezifischen Mausmodells welches das klinische Erscheinungsbild von PSC-CCA widerspiegelt. Dieses dient nicht nur zur Überprüfung unserer erhobenen humanen Daten, sondern wird auch für die Erprobung von Therapeutika herangezogen werden können.
Zusammenfassend werden die Ergebnisse dieses Projekts sowohl zum Verständnis der Pathogenese des PSC-CCA beitragen können, als auch immunologische Mechanismen aufdecken und die klinische Translation potenzieller therapeutischer Targets ermöglichen.
Projektleitung
Prof. Dr. med.Nicola Gagliani- Leiter Forschungslabor
Standort
Campus Forschung I - N27 , 3. EtageWissenschaftliche Mitarbeiter / Clinician Scientists
Dr. med.Jenny Krause- Assistenzärztin
- Zentrum für Innere Medizin
- I. Medizinische Klinik und Poliklinik (Gastroenterologie mit Sektionen Infektiologie und Tropenmedizin)
- Assistenzärztin in Weiterbildung
Standort
O49 , EG, Raumnummer 4Aktuelle projektbezogene Publikationen
Poch T, Krause J, Casar C, Liwinski T, Glau L, Kaufmann M, Ahrenstorf AE, Hess LU, Ziegler AE, Martrus G, Lunemann S, Sebode M, Li J, Schwinge D, Krebs CF, Franke A, Friese MA, Oldhafer KJ, Fischer L, Altfeld M, Lohse AW, Huber S, Tolosa E, Gagliani N*, Schramm C*. Single-cell atlas of hepatic T cells reveals expansion of liver-resident naive-like CD4+ T cells in primary sclerosing cholangitis. J Hepatol 2021;S0168-8278(21)00219-1.
Muscate F, Woestemeier A, Gagliani N. Functional heterogeneity of CD4+ T cells in liver inflammation. Semin Immunopathol. 2021 Aug 31. doi: 10.1007/s00281-021-00881-w. Epub ahead of print. PMID: 34463867.
Krause J, Ehlken H, Schramm C. Diagnostik und Therapie unklarer Gallengangsstenosen. Dtsch Med Wochenschr 2020;145:306-12.
Roncarolo MG, Gregori S, Bacchetta R, Battaglia M, Gagliani N. The Biology of T Regulatory Type 1 Cells and Their Therapeutic Application in Immune-Mediated Diseases. Immunity 2018;49:1004–19.
Brockmann L, Steglich B, Czarnewski P, Soukou S, Zhao L, Wende S, Bedke T, Agalioti T, Geffken M, Seiz O, Parigi SM, Sorini C, Geginat J, Fujio K, Jacobs T, Roesch T, Jacob R. Izbicki JR, Lohse A, Flavell FA, Krebs C, Villablanca EJ and Gagliani N* and Huber S*. Analysis of molecular and + functional heterogeneity of IL-10 producing CD4 T cells reveals a defect in tolerance in inflammatory bowel disease patients. Nat Commun 2018;9:5457.
Sorini C, Cardoso RF, Gagliani N, Villablanca EJ. Commensal Bacteria-Specific CD4+ T Cell Responses in Health and Disease. Front Immunol 2018;9:2667.
Agalioti T, Villablanca EJ, Huber S, Gagliani N. TH17 cell plasticity: The role of dendritic cells and molecular mechanisms. J Autoimmun 2018;87:50–60.
Gagliani N, Vesely MC, Iseppon A, Brockmann L, Xu H, Palm NW, de Zoete MR, Licona-Limon P, Paiva RS, Ching T, Weaver C, Zi X, Pan X, Fan R, Garmire LX, Cotton MJ, Drier Y, Bernstein B, Geginat J, Stockinger B, Esplugues E, Huber S*, Flavell RA*. TH17 cells transdifferentiate into regulatory T cells during resolution of inflammation. Nature 2015;523:221-5.
*equally contributing authors
-
Projekt C: Krankheitsmodellbildung mit Hilfe des PSC Integrative Data Environment (PrIDE)
Projekt C
Krankheitsmodellbildung mit Hilfe des PSC Integrative Data Environment (PrIDE)
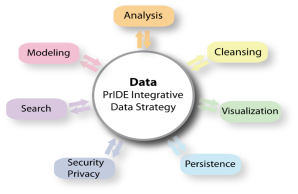
Primäre sklerosierende Cholangitis (PSC) ist eine bis dato nur unzulänglich verstandene und deshalb schwer therapierbare Krankheit, die oft mit chronisch-entzündlichen Darmerkrankungen (IBD Varianten) einhergeht. Insbesondere spricht die Datenlage dafür, dass es sich bei PSC um ein Spektrum mehrerer überlappender Krankheitsbilder handelt, die sich bezüglich ihrer Komorbiditäten, ihrer Genetik und ihres Immunotyps unterscheiden. In diesem Projekt ist es unser Ziel, mit Hilfe einer kombinierten Analyse dieser Daten experimentell überprüfbare Hypothesen zur Pathogenese von PSC und ihrer Subphänotpyen zu generieren. Dafür entwickeln wir PrIDE, eine öffentlich zugängliche Datenintegrationsplattform, die PSC-relevante Daten interaktiv visualisiert und analysiert. PrIDE unterstützt die ontologiebasierte Annotation und soll NGS, omics-Daten, FACS und Cytokinmessungen sowie klinische Patientendaten integrieren. Desweiteren werden Daten von öffentlichen Daten-banken sowie publizierte (strukturierte und unstrukturierte) Daten miteinbezogen.
PrIDE soll im Rahmen dieses Teilprojekts genutzt werden, um den Einfluss kommensaler und pathogener Keime auf den Immunstatus und PSC Subphänotypen zu verstehen und so zu einer Stratifizierung bezüglich der Komorbiditäten der PSC (IBD, CCA), des Mikrobioms und möglicher Infektionen beizutragen. Potenzielle Kausalitäten werden wir anhand unterschiedlicher Krankheitsstadien (Pseudo-Chronologie) untersuchen. Diese hypothetischen Krankheitsmodelle sind experimentell bestätig- und widerlegbar.
Desweiteren wollen wir Mausmodelle, welche Teilaspekte der PSC repräsentieren, bezüglich ihres Translationspotentials auf die Subphänotypen der humanen PSC untersuchen. Dazu werden wir die RNA-seq Daten aus der Leber von Mausmodellen mit denen menschlicher Leber vergleichen.
Projektleiter
Prof. Dr.Stefan Bonn- Institutsdirektor
Standort
N25 - HCTI, EG, Raumnummer 27Prof. Dr. rer. nat.
Andre Franke
Direktor, Institut für Klinische Molekularbiologie (IKMB), Christian-Albrechts-Universität zu Kiel (CAU), Universitätsklinikum Schleswig Holstein • Campus Kiel, Schittenhelmstr. 12, 24105 Kiel
Wissenschaftliche Mitarbeiter
Sven Heins- Wissenschaftlicher Mitarbeiter
Standort
N25 - HCTI, EG, Raumnummer 23Aktuelle projektbezogene Publikationen
Rahman RU, Liebhoff AM, Bansal V, Fiosins M, Rajput A, Sattar A, Magruder DS, Madan S, Sun T, Gautam A, Heins S, Liwinski T, Bethune J, Trenkwalder C, Fluck J, Mollenhauer B, Bonn S. SEAweb: the small RNA Expression Atlas web application. Nucleic Acids Res 2020;48:D204-D19.
Wang Y, Miller M, Astrakhan Y, Petersen BS, Schreiber S, Franke A, Bromberg Y Identifying Crohn's disease signal from variome analysis. Genome Med 2019;11:59.
Pryor R, Norvaisas P, Marinos G, Best L, Thingholm LB, Quintaneiro LM, De Haes W, Esser D, Waschina S, Lujan C, Smith RL, Scott TA, Martinez-Martinez D, Woodward O, Bryson K, Laudes M, Lieb W, Houtkooper RH, Franke A, Temmerman L, Bjedov I, Cochemé HM, Kaleta C, Cabreiro F. Host-Microbe-Drug-Nutrient Screen Identifies Bacterial Effectors of Metformin Therapy. Cell 2019;178:1299-1312.e29.
Thingholm LB, Rühlemann MC, Koch M, Fuqua B, Laucke G, Boehm R, Bang C, Franzosa EA, Hübenthal M, Rahnavard A, Frost F, Lloyd-Price J, Schirmer M, Lusis AJ, Vulpe CD, Lerch MM, Homuth G, Kacprowski T, Schmidt CO, Nöthlings U, Karlsen TH, Lieb W, Laudes M, Franke A, Huttenhower C. Obese Individuals with and without Type 2 Diabetes Show Different Gut Microbial Functional Capacity and Composition. Cell Host Microbe 2019;26:252-64.e10.
Degenhardt F, Wendorff M, Wittig M, Ellinghaus E, Datta LW, Schembri J, Ng SC, Rosati E, Hübenthal M, Ellinghaus D, Jung ES, Lieb W, Abedian S, Malekzadeh R, Cheon JH, Ellul P, Sood A, Midha V, Thelma BK, Wong SH, Schreiber S, Yamazaki K, Kubo M, Boucher G, Rioux JD, Lenz TL, Brant SR, Franke A. Construction and benchmarking of a multi-ethnic reference panel for the imputation of HLA class I and II alleles. Hum Mol Genet 2019;28:2078-92.
Rahman RU, Gautam A, Bethune J, Sattar A, Fiosins M, Magruder DS, Capece V, Shomroni O, Bonn S. Oasis 2: improved online analysis of small RNA-seq data. BMC Bioinformatics 2018;19:54.
Bauer CR, Knecht C, Fretter C, Baum B, Jendrossek S, Rühlemann M, Heinsen FA, Umbach N, Grimbacher B, Franke A, Lieb W, Krawczak M, Hütt MT, Sax U. Interdisciplinary approach towards a systems medicine toolbox using the example of inflammatory diseases. Brief Bioinform 2017;1;18:479-87.
Hatje K, Rahman RU, Vidal RO, Simm D, Hammesfahr B, Bansal V, Rajput A, Mickael ME, Sun T, Bonn S, Kollmar M. The landscape of human mutually exclusive splicing. Molecular Systems Biology 2017;13:959.
Die KFO306 strukturiert und fördert darüber hinaus die Rekrutierung und Ausbildung von Nachwuchswissenschaftlern im Rahmen des Clinician Scientist Programms.
Leitung
Sprecher der KFO 306

- Klinikdirektor
- Zentrum für Innere Medizin
- I. Medizinische Klinik und Poliklinik (Gastroenterologie mit Sektionen Infektiologie und Tropenmedizin)
- Facharzt für Innere Medizin und Gastroenterologie
Leiter der Klinischen Forschungsgruppe

- Oberarzt
- Helmut und Hannelore Greve Stiftungsprofessur
- Zentrum für Innere Medizin
- I. Medizinische Klinik und Poliklinik (Gastroenterologie mit Sektionen Infektiologie und Tropenmedizin)
- Facharzt für Innere Medizin und Gastroenterologie
Mercator-Fellow
Univ. Prof. Dr. Michael Trauner
Klinische Abteilung für Gastroenterologie und Hepatologie, Medizinische Universität Wien
Koordinatorin der KFO
- Studienkoordinatorin