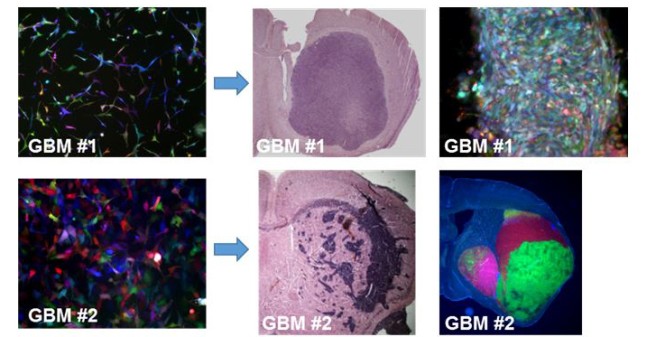
Abb. 1 RGB/LeGO Markierung und in vitro/in vivo Wachstum zweier verschiedener Glioblastomzelllinien. Die Transduktion beider Zelllinien resultierte in vitro in einer Vielzahl bunter Mischfarben (links). Nach Injektion der Zellen in das Hirn von Nacktmäusen (Mitte) bildete die erste Glioblastomzelllinie (GBM #1) Tumore (Mitte), aus einer bunt gemischten Vielzahl unterschiedlich gefärbter Tumorzellen bestanden. Demgegenüber waren bei der anderen Zelllinie nur wenige Klone (ca. 5) in vivo tumorinitiierend.
Klonale Analysen zur intratumoralen Heterogenität von Glioblastomen
Glioblastome sind heterogene Tumore. Zum einen unterscheiden sich Glioblastome verschiedener Patienten bezüglich ihrer genetischen Veränderungen und ihres Wachstumsverhaltens erheblich voneinander (intertumorale Heterogenität), zum anderen besteht auch innerhalb einzelner Tumore eine erhebliche intratumorale Heterogenität. So ist z.B. in Glioblastomen mit EGFRvIII Mutation ( vgl. Webseite zum EGFR ) typischerweise nur ein Teil der Tumorzellen von der Mutation betroffen. Auch Amplifikationen der Rezeptorgene MET und PDGFRA betreffen typischerweise nur eine Teil der Zellen in einem Glioblastoms, so dass die Tumore genetisch hochkomplex sind. Demzufolge können die Tumorzellen sehr unterschiedlich auf verschiedene Therapiestrategien ansprechen. Neben der genetischen Heterogenität besteht auch eine erhebliche intratumorale phänotypische Heterogenität. Morphologisch finden sich Nekrosen, die oft umgeben sind von dichten, pseudopalisadenförmigen Tumorzellrandwällen, Areale mit starker Blutgefäßneubildung (Angiogenese, Gefäßproliferate), diffus-invasive Randregionen und auch Areale, die stark von Immunzellen infiltriert sein können. Die Genexpressionsprofile der Tumorzellen in diesen unterschiedlichen Regionen unterscheiden sich teilweise erheblich. So ist beispielsweise in invadierenden Tumorzellen neben pro-migratorischen Genen die Expression von anti-apoptotischen Genen heraufreguliert, was eine therapeutische Angreifbarkeit durch Apoptose-induzierende Substanzen erschwert. Um das heterogene Ansprechen individueller Tumorzellen auf unterschiedliche therapeutische Strategien untersuchen zu können und Resistenzmechanismen von Zellsubpopulationen identifizieren können, ist es erforderlich, das Schicksal einzelner Zellen bei Therapie in vitro und in vivo verfolgen zu können. Hierzu eignet sich ein klonales Farbmarkierungssystem, bei dem lentivirale Vektoren (LeGO) Vektoren, die für rot-grün-blau (RGB)-fluoresziierende Proteine kodieren in Zellen hineintransduziert werden1. Abhängig von Kombination, Kopiezahl, und Expressionsintensität der Vektoren entstehen bis zu 40000 mögliche Mischfarben, so dass jede Zelle durch eine individuelle Farbe fluoreszenzmarkiert ist. Unterschiedliche Glioblastomzelllinien, die mit dieser Technik markiert wurden, bilden im Hirn von Mäusen Tumore, die teilweise sehr unterschiedliche klonale Zusammensetzungen aufweisen2. Während Tumoren manche Tumore offensichtlich nur aus wenigen Klonen bestehen, sind Tumore anderer Zelllinien aus einer bunten Vielzahl tumorinitiierender Zellen zusammengesetzt.
Problematisch bei dieser Methode ist, dass einzelne Tumore wie z.B. GBM #1 aus außerordentlich vielen Zellen bestehen können, deren Zellen sich aufgrund überlappender Farbspektren anschließend nicht mehr zuverlässig durch Zell-Sorting separieren lassen. Es muss daher ein Zellmarkierungssystems etabliert werden, bei dem auch nach Wachstum von Xenotransplantattumoren in Mäusehirnen noch eine Zuordnung, Sortierung und Re-Analyse der Zellen möglich ist. Hiermit können dann Untersuchungen zur Tumorinitiierungsfähigkeit in vivo, zur metabolischen Adaptation, zur Therapieresistenz und zur Interaktion der Tumorzellen mit dem Immunsystem erfolgen.